Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Название:Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1980
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи краткое содержание
Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
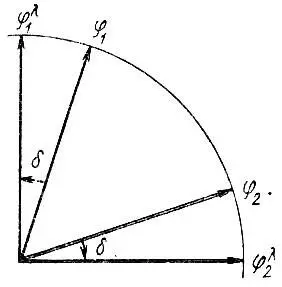
Рис. 24. Геометрическая иллюстрация лёвдинской ортогонализации двух неортогональных векторов φ 1и φ 2
Как показали Слэтер и Костер, ортонормировка по Лёвдину сохраняет трансформационные свойства неортогонального базиса в том смысле, что при унитарном преобразовании базиса {φ} соответствующий лёвдинский базис {φ λ} преобразуется той же унитарной матрицей. Отсюда следует, в частности, что орбитали φ λ аисходного многоцентрового базиса АО и соответствующие им орбитали φ λ aпреобразуются по одним и тем же представлениям подгруппы G Aточечной группы симметрии молекулы (G). При этом подгруппа G Aвключает только те преобразования группы G, которые не затрагивают центр А (т, е, ядро атома A). Таким образом, орбитали φ aи ф λ aобладают одинаковыми свойствами симметрии относительно указанных преобразований.
Согласно теореме Карлсона и Келлера, лёвдинский базис 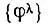 отличается от всех прочих базисов, полученных ортогонализацией исходного базиса {φ}, максимальной близостью к {φ} в смысле минимума среднеквадратического отклонения
отличается от всех прочих базисов, полученных ортогонализацией исходного базиса {φ}, максимальной близостью к {φ} в смысле минимума среднеквадратического отклонения
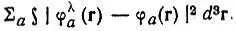 (4.74)
(4.74)
Представление об изменении формы и размеров атомных орбиталей при их ортогонализации можно получить, сравнивая средние значения 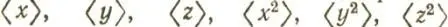 и
и 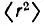 или среднеквадратические радиусы
или среднеквадратические радиусы 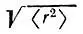 Для сферических АО с соответствующими значениями для ортогонализованных орбиталей. Такие вычисления (в табл. 8 приведены результаты для молекулы N 2) свидетельствуют, что орбитали лёвдинского базиса, соответствующие валентным АО, могут быть локализованными в окрестности атомных ядер в большей степени, чем исходные. Сжатие орбиталей наблюдается как в "поперечном", так и в "продольном" направлениях. 1s-Орбитали внутренних оболочек при ортогонализации несколько расширяются, оставаясь тем не менее существенно локализованными у своих ядер. Среднеквадратический радиус этих орбиталей в несколько раз меньше, чем валентных.
Для сферических АО с соответствующими значениями для ортогонализованных орбиталей. Такие вычисления (в табл. 8 приведены результаты для молекулы N 2) свидетельствуют, что орбитали лёвдинского базиса, соответствующие валентным АО, могут быть локализованными в окрестности атомных ядер в большей степени, чем исходные. Сжатие орбиталей наблюдается как в "поперечном", так и в "продольном" направлениях. 1s-Орбитали внутренних оболочек при ортогонализации несколько расширяются, оставаясь тем не менее существенно локализованными у своих ядер. Среднеквадратический радиус этих орбиталей в несколько раз меньше, чем валентных.
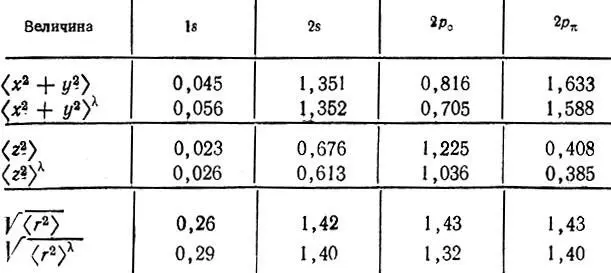
Таблица 8. Средние значения 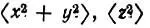 и среднеквадратические радиусы
и среднеквадратические радиусы 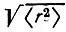 характеризующие АО азота и соответствующие лёвдинские орбитали в молекуле N 2
характеризующие АО азота и соответствующие лёвдинские орбитали в молекуле N 2
С учетом сказанного выше, аддитивные (лёвдинские) заселенности (n 0) орбиталей неортогонального базиса φ следует отождествлять с заселенностями соответствующего лёвдинского базиса:
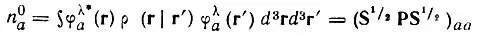 (4.75)
(4.75)
Формальный зарядq Aатома А определяется зарядом его ядра Z Aи аддитивными заселенностями представляющих этот атом орбиталей:
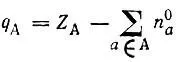 (4.76)div> формальные заряды атомов отражают перераспределение электронной плотности при образовании молекулы и являются полезной характеристикой валентного состояния атома. В частности,они позволяют производить интерполяцию атомных свойств по известным свойствам свободных атомов. Так, потенциалы ионизации химически связанных атомов могут оцениваться по формуле
(4.76)div> формальные заряды атомов отражают перераспределение электронной плотности при образовании молекулы и являются полезной характеристикой валентного состояния атома. В частности,они позволяют производить интерполяцию атомных свойств по известным свойствам свободных атомов. Так, потенциалы ионизации химически связанных атомов могут оцениваться по формуле
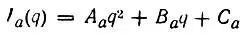 (4.77)
(4.77)
Следует отметить сильную зависимость потенциала ионизации Вот заряда атома. Несколько примеров, характеризующих эту зависимость, приведено в табл. 9.
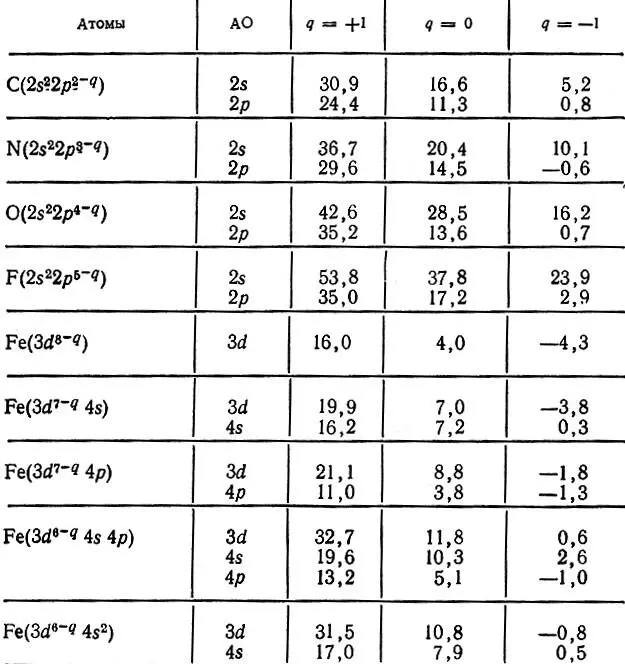
Таблица 9. Зависимость орбитальных потенциалов ионизации от атомного заряда q (экспериментальные данные) [27]
Формальные заряды атомов используются часто для оценки энергии электростатического взаимодействия
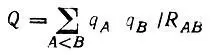 (4.78)
(4.78)
и для определения дипольных моментов больших молекул в точечном приближении
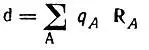 (4.79)
(4.79)
Рассмотрим теперь несколько примеров, иллюстрирующих вложенный формализм анализа заселенностей многоцентрового азиса перекрывающихся АО.
1. Для молекулы Н 2для π-электронных оболочек молекул азота (N 2), этилена, ацетилена и для ряда других аналогичных двухорбитальных систем, содержащих по два электрона, матрица плотности и заселенности АО определяются симметрией и перекрыванием базисных АО:
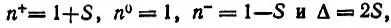
где интеграл перекрывания АО S>0. Уменьшая расстояние между атомами, в пределе мы получим
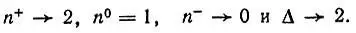
Напротив, при бесконечном разведении атомов
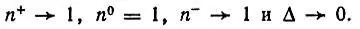
2. π-Электронные системы в молекулах F 2, ClF и в других аналогичных молекулах независимо от их симметрии (D ∞hили C ∞h) характеризуются заселенностями АО π-типа
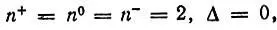
которые не зависят от интегралов перекрывания. Эти АО представляют неподеленные электронные пары соответствующих атомов.
3. Валентное состояние атома Li в молекуле LiH (табл. 10) характеризуется положительным формальным зарядом и существенным перераспределением электронной плотности между 2s-орбиталью и виртуальной (для основной конфигурации свободного атома Li) 2pσ-орбиталью. Две эти АО незначительно различаются по заселенности перекрывания в молекуле LiH, в то время как 1s-AO лития практически не участвует в образовании химической связи и представляет неподеленную электронную пару атомного остова.
Читать дальшеИнтервал:
Закладка:









