Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Название:Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи
- Автор:
- Жанр:
- Издательство:неизвестно
- Год:1980
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Игорь Дмитриев - Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи краткое содержание
Квантовая химия — ее прошлое и настоящее. Развитие электронных представлений о природе химической связи - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
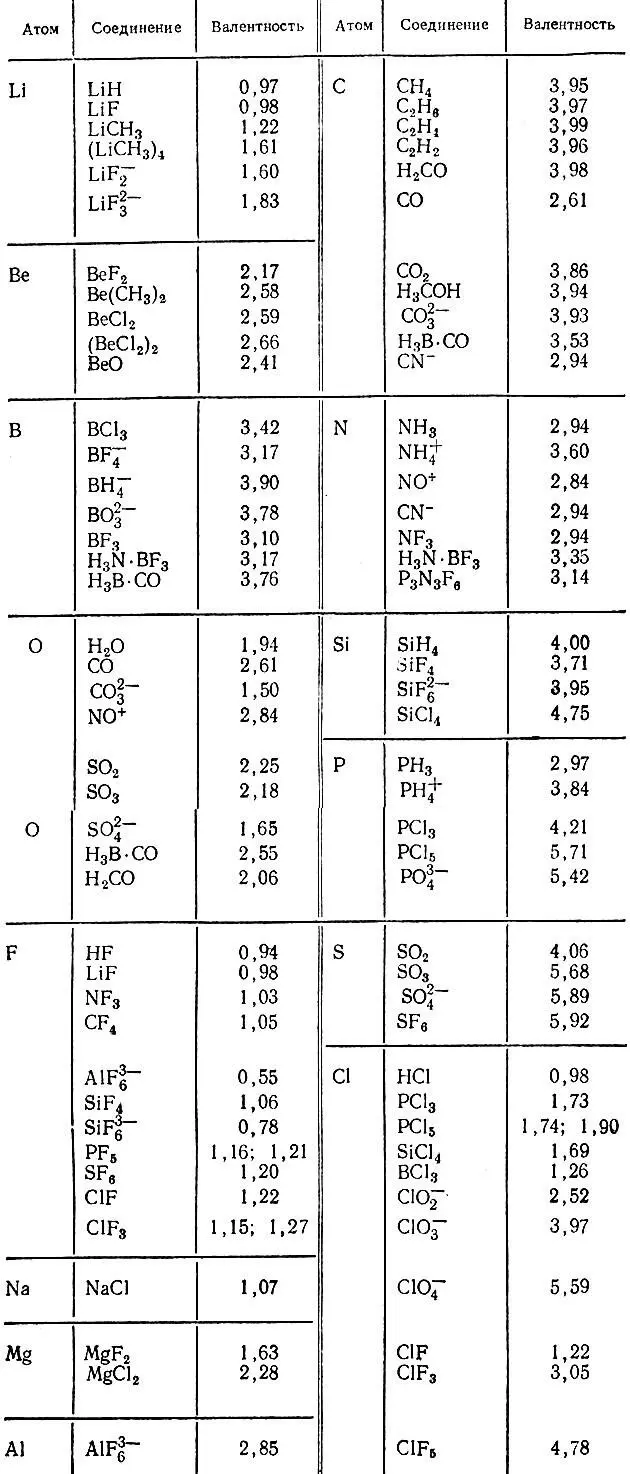
Таблица 14. Валентности атомов от лития до хлора в различных химических соединениях [30]
Значительный интерес представляет исследование валентности элементов, атомы которых обладают незаполненными d-оболочками. Армстронг, Фортуне и Перкинс [28] вычислили атомные заряды, индексы связей и валентности атомов в экзотической с точки зрения классической теории химической связи соли Цейзе К[C 2H 2PtCl 3], а также в комплексных ионах платины транс -[РtXCl 3] -и транс -[PtX(NH 3)Cl 2]. Результаты вычислений приведены в табл. 15 и 16. Спектр валентности лежит в пределах от 2,3 до 2,9, причем ее связи с лигандами характеризуются существенно дробными индексами К ≈ 0,7. Пониженные по отношению к ординарной связи (К = 1) значения этих индексов обусловлены отчасти полярностью связей, отчасти их делокализацией. При сопоставлении валентных структур молекулы этилена в свободном состоянии и в составе соли Цейзе можно видеть, что валентность углерода и водорода при комплексообразовании практически не меняется. То же самое можно сказать и о формальных зарядах этих атомов. Заметно понижается кратность связи углерод-углерод, но вместе с тем в комплексном анионе [C 2H 2PtCl 3] -реализуются СВЯЗИ платины с атомами углерода, характеризуемые значениями К PtС= 0,33. Это обстоятельство влечет повышение валентности платины в соли Цейзе до 2,90 и обеспечивает неизменность валентности углерода.
Более детальное исследование валентной структуры комплексных соединений платины было проведено О. В. Сизовой и В. И. Барановским [24]. В частности, обобщая понятие валентности атома на многоатомные лиганды (L) и характеризуя σ- и π-донорную и акцепторную способность последних с помощью σ- и π-составляющих валентности V L, они классифицировали одиннадцать важнейших лигандов по их донорной и акцепторной активности. Была рассмотрена также зависимость свойств лигандов от состава комплекса и взаимное влияние лигандов, передаваемое через орбитали центрального атома.
Почему образуется химическая связь?
Традиционно образование химической связи объясняют понижением потенциальной энергии при сближении атомов, которое превосходит повышение кинетической энергии, так что алгебраическая сумма этих двух величин оказывается отрицательной. Однако, как было показано Рюденбергом [21], в действительности дело обстоит сложнее. По мнению Рюденберга, образование химической связи обусловлено преимущественно понижением кинетической энергии электронов вследствие их большей делокализации в молекуле, чем в невзаимодействующих атомах. Более детальный анализ проблемы был проведен Годдардом и Уильсоном [44] на примере молекулы водорода с использованием обобщенного метода ВС. Согласно этому методу, двухэлектронная функция молекулы Н 2может быть записана с точностью до нормировочного множителя в виде
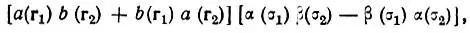 (4.102)
(4.102)
где а( r) и b( r) — неортогональные молекулярные орбитали, оптимизированные для каждого межъядерного расстояния R.
При этом энергия обменного взаимодействия атомов водорода (Е х) может быть представлена как сумма кинетической ( 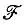 х) и потенциальных ядерной (V nx) и электронной (V ех) составляющих:
х) и потенциальных ядерной (V nx) и электронной (V ех) составляющих:
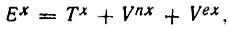 (4.103)
(4.103)
где
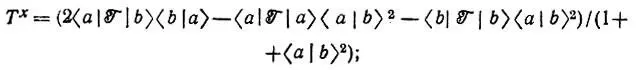 (4.104)
(4.104)
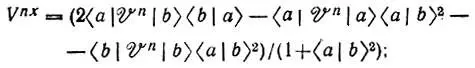 (4.105)
(4.105)
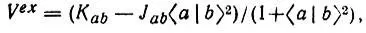 (4.106)
(4.106)
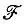
— оператор кинетической энергии электронов; V n — оператор потенциальной энергии ядер; К аb , Т ab — обменный и кулоновский интегралы.
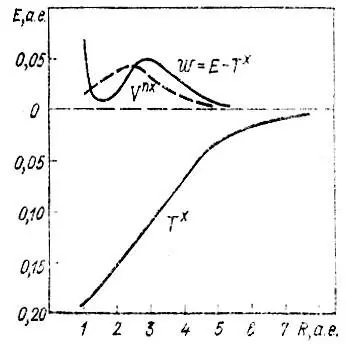
Рис. 26. Отдельные компоненты полной энергии молекулы Н 2как функци межъядерного расстояния (по Годдарду)
Оказывается, что из Е хможно выделить члены, отвечающие за образование связи. Из рис. 25, на котором изображены полученные Годдардом кривые зависимости величин T x, V nx, а также разности w = E — T xот R, видно, что единственной отрицательной составляющей обменной энергии является Т х, причем ее понижение относительно Т R=∞ xпревосходит соответствующее изменение прочих составляющих энергии (Δw.) Чтобы объяснить этот факт, перепишем выражения для T xи V nxв следующем виде:
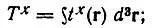 (4.107)
(4.107)
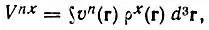 (4.108)
(4.108)
где "обменная матрица плотности"
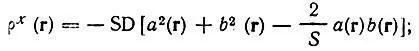 (4.109)
(4.109)
v n— потенциал ядер и локальная кинетическая энергия
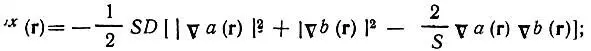 (4.110)
(4.110)
 — оператор градиента.
— оператор градиента.
Существенным является то, что в то время как в выражение для "обменной" матрицы плотности входят произведения орбиталей а( r) и b( r), величина t xвключает градиенты этих орбиталей. Если обе орбитали в области связи имеют одинаковые знаки, то можно ожидать, что величина ρ xбудет мала в этой области вследствие частичной компенсации членов в квадратных скобках. Для величины t x, напротив, следует ожидать большого по абсолютной величине и отрицательного значения. Действительно, в области связи одна из орбиталей убывает, в то время как другая — возрастает, и градиенты этих орбиталей имеют различные знаки. Поэтому каждый член в квадратных скобках формулы (4.110) будет положительным.
До сих пор речь шла о низшем синглетном состоянии молекулы водорода. Для этого состояния ρ хв области связи положительна (хотя и мала). Для триплетного состояния, соответствующего отталкиванию ядер атомов водорода без образования ими стабильной молекулы, можно показать, что величина ρ хотрицательна. Это создает иллюзию, будто причиной образования молекулы является увеличение электронной плотности между ядрами. Такая точка зрения ие соответствует, однако, действительности. Следуя Годдарду, мы показали выше, что причиной образования химической связи правильнее считать благоприятную конградиентность орбиталей, реализующих связь. Однако следствием благоприятной конградиентности являются также положительные значения ρ x. Иначе, концентрация электронной плотности в области связи, уменьшение локальной кинетической энергии в этой же области и образование стабильной молекулы являются следствиями одной и той же причины — благоприятной конградиентности орбиталей.
Читать дальшеИнтервал:
Закладка:









