М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса –оваяи слова «кислота»: HCOOH – метановая (муравьиная) кислота, CH 3COOH – этановая (уксусная) кислота. Для карбоновых кислот характерная структурная изомерия: а) изомерия скелета в углеводородном радикале (начиная с С 4); б) межклассовая изомерия, начиная с С 2. Возможна цис-транс-изомерия в случае непредельных карбоновых кислот. Электронная плотность π - связи в карбонильной группе смещена в сторону атома кислорода. Вследствие этого у карбонильного углерода создается недостаток электронной плотности, и он притягивает к себе неподеленные пары атома кислорода гидроксильной группы, в результате чего электронная плотность связи О—Н смещается в сторону атома кислорода, водород становится подвижным и приобретает способность отщепляться в виде протона.
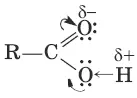
В водном растворе карбоновые кислоты диссоциируют на ионы:
R—COOH ↔ R—COО¯ + Н +
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
1. CH 3—СCl 3+ 3NaOH → CH 3—COOH + 3NaCl + Н 2O (гидролиз тригалогенопроизводных)
2. R—CHO + [О] → R—COOH (окисление альдегидов и кетонов)
3. CH 3—CH=CH 2+ CO + Н 2O/Н +→ Ni, р, t → CH 3—CH 2—CH 2—COOH (оксосинтез)
4. CH 3C≡N + 2Н 2O/ Н + → CH 3COOH + NH 4(гидролиз нитрилов)
5. CO + NaOH → HCOONa; 2HCOONa + H 2SO 4 → 2HCOOH + Na 2SO 4(получение HCOOH)
Карбоновые кислоты проявляют высокую реакционную способность и вступают в реакции с различными веществами, образуя разнообразные соединения, среди которых большое значение имеют функциональные производные: сложные эфиры, амиды, нитрилы, соли, ангидриды, гало-генангидриды.
1. а) 2CH 3COOH + Fe → (CH 3COO) 2Fe + Н 2(образование солей)
б) 2CH 3COOH + MgO → (CH 3COO) 2Mg + Н 2O
в) CH 3COOH + KOH → CH 3COОК + Н 2O
г) CH 3COOH + NaHCO 3 → CH 3COONa + CO 2+ Н 2O
CH 3COONa + H 2O ↔ CH 3COOH + NaOH (соли карбоновых кислот гидролизуются)
2. (образование вложных эфиров)
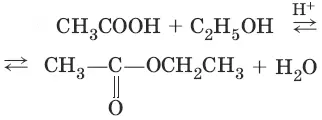
(омыление вложного эфира)
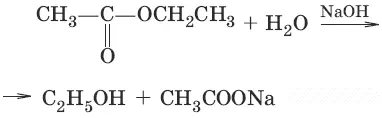
3. (получение хлорангидридов кислот)
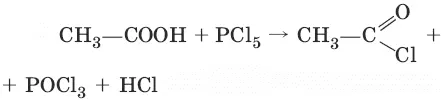
4. (разложение водой)
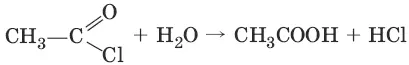
5. CH 3—COOH + Cl 2 → hv → Cl—CH 2—COOH + HCl (галогенирование в α-положение)
6. HO—CH=O + Ag 2O → NH 3 → 2Ag + Н 2CO 3(Н 2O + CO 2) (особенности HCOOH)
HCOOH → t → CO + Н 2O
12. Жиры
Жиры– сложные эфиры глицерина и высших одноатомных карбоновых кислот. Общее название таких соединений – триглицериды. В состав природных триглицеридов входят остатки насыщенных кислот (пальмитиновой С 15Н 31COOH, стеариновой С 17Н 35COOH) и ненасыщенных (олеиновой С 17Н 33COOH, линолевой С 17Н 31COOH). Жиры состоят главным образом из триглицеридов предельных кислот. Растительные жиры – масла (подсолнечное, соевое) – жидкости. В состав триглицеридов масел входят остатки непредельных кислот.
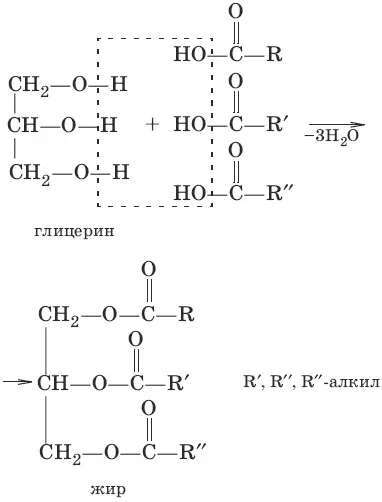
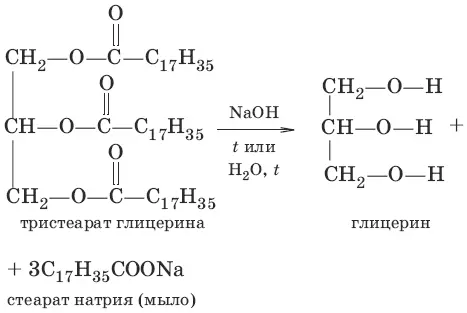
Жирам как сложным эфирам свойственна обратимая реакция гидролиза, катализируемая минеральными кислотами. При участии щелочей гидролиз жиров происходит необратимо. Продуктами в этом случае являются мыла – соли высших карбоновых кислот и щелочных металлов. Натриевые соли – твердые мыла, калиевые – жидкие. Реакция щелочного гидролиза жиров называется также омылением.
13. Амины
Амины – органические производные аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы. В зависимости от числа углеводородных радикалов различают первичные RNH 2, вторичные R 2NH, третичные R 3N амины. По характеру углеводородного радикала амины подразделяются на алифатические (жирные), ароматические и смешанные (или жирноароматические). Названия аминов в большинстве случаев образуют из названий углеводородных радикалов и суффикса –амин.Например, CH 3NH 2– метиламин; CH 3—CH 2—NH 2– этиламин. Если амин содержит различные радикалы, то их перечисляют в алфавитном порядке: CH 3—CH 2—NH—CH 3– ме-тилэтиламин.
Изомерия аминов определяется количеством и строением радикалов, а также положением аминогруппы. Связь N—Н является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи. Третичные амины не образуют ассоциирующих водородных связей. Амины способны к образованию водородных связей с водой. Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается.
1. R—NO 2+ 6[Н] → R—NH 2+ 2H 2O (восстановление нитросоединений)
2. NH 3+ CH 3I → [CH 3N +H 3]I¯ → NH 3 → CH 3NH 2+ NH 4I (алкилирование аммиака)
3. а) С 6Н 5—NO 2+ 3(NH 4) 2S → С 6Н 5—NH 2+ 3S + 6NH 3+ 2H 2O (реакция Зинина)
б) С 6Н 5—NO 2+ 3Fe + 6HCl → С 6Н 5—NH 2+ 3FeCl 2+ 2Н 2O (восстановление нитросоединений)
в) С 6Н 5—NO 2+ ЗН 2 → катализатор, t → C 6H 5—NH 2+ 2Н 2O
4. R—C≡N + 4[H] → RCH 2NH 2(восстановление нитрилов)
5. ROH + NH 3→ Al 2O 3,350 °C → RNH 2+ 2H 2O (получение низших алкиламинов С 2—С 4)
Амины имеют сходное с аммиаком строение и проявляют подобные ему свойства. Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов. Для аминов характерны ярко выраженные основные свойства. Водные растворы алифатических аминов проявляют щелочную реакцию. Алифатические амины – более сильные основания, чем аммиак. Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку не-поделенная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
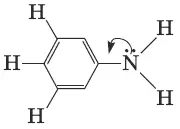
На основность аминов влияют различные факторы: электронные эффекты углеводородных радикалов, пространственное экранирование радикалами атома азота, а также способность образующихся ионов к стабилизации за счет сольватации в среде растворителя. В результате донорного эффекта алкильных групп основность алифатических аминов в газовой фазе (без растворителя) растет в ряду: первичные < вторичные < третичные. Основность ароматических аминов зависит также от характера заместителей в бензольном кольце. Электроноакцепторные заместители (—F, —Cl, —NO 2и т. п.) уменьшают основные свойства ариламина по сравнению с анилином, а электронодонорные (алкил R—, —OCH 3, —N(CH 3) 2и др.), напротив, увеличивают.
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





