М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Для фенолов реакции разрыва связи С—О не характерны. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра.
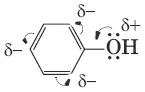
Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно в орто– и пара- положениях (+М-эффект OH-группы). Для обнаружения фенолов используется качественная реакция с хлоридом железа(III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
1. 2С 6Н 5OH + 2Na → 2C 6H 5ONa + Н 2(так же, как и этанол)
2. С 6Н 5OH + NaOH → C 6H 5ONa + H 2O (в отличие от этанола)
C 6H 5ONa + Н 2O + CO 2 → С 6Н 5OH + NaHCO 3(фенол более слабая кислота, чем угольная)
3.
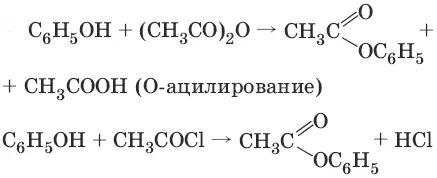
Фенолы не образуют сложные эфиры в реакциях с кислотами. Для этого используются более реакционноспособные производные кислот (ангидриды, хлорангидриды).
4. С 6Н 5OH + CH 3CH 2OH → NaOH → С 6Н 5OCH 2CH 3+ NaBr (О-алкилирование)
5.
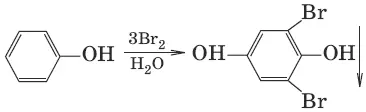
(взаимодействие с бромной водой, качественная реакция)
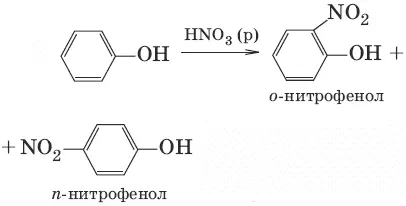
6.(нитрование разб. HNO 3, при нитрировании конц. HNO 3образуется 2,4,6-тринитрофенол)
7. n C 6H 5OH + n CH 2O → n H 2O + (—C 6H 3OH—CH 2—) n (поликонденсация, получение фенолформальдегидных смол)
10. Альдегиды и кетоны
Альдегидами называются соединения, в которых карбонильная группа
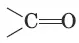
соединена с углеводородным радикалом и атомом водорода, а кетонами – карбонильные соединения с двумя углеводородными радикалами.
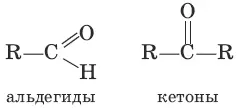
Систематические названия альдегидов строят по названию соответствующего углеводорода с добавлением суффикса –аль. Нумерацию цепи начинают с карбонильного атома углерода. Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении: Н 2С=O – метаналь (муравьиный альдегид, формальдегид); CH 3CH=O – этаналь (уксусный альдегид). Систематические названия кетонов несложного строения производят от названий радикалов с добавлением слова «кетон». В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса –он; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе. Примеры: CH 3—CO—CH 3– диметилкетон (пропанон, ацетон). Для альдегидов и кетонов характерна структурная изомерия. Изомерия альдегидов: а) изомерия углеродного скелета, начиная с С 4; б) межклассовая изомерия. Изомерия кетонов: а) углеродного скелета (с С 5); б) положения карбонильной группы (с С 5); в) межклассовая изомерия.
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp 2- гибридизации. Связь С=O сильно полярна. Электроны кратной связи С=O смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда, а карбонильный атом углерода приобретает частичный положительный заряд.
1. а) (дегидрирование, окисление первичных спиртов)
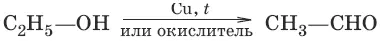
б) (дегидрирование, окисление вторичных спиртов)
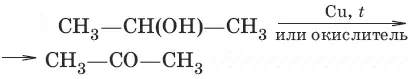
2. а) CH 3CH 2CHCl 2+ 2NaOH → в воде → CH 3CH 2CHO + 2NaCl + H 2O (гидролиз дигалогенопроизводных)
б) CH 3СCl 2CH 3+ 2NaOH → в воде → CH 3COCH 3+ 2NaCl + H 2O
3. (гидратация алкинов, реакция Кучерова)
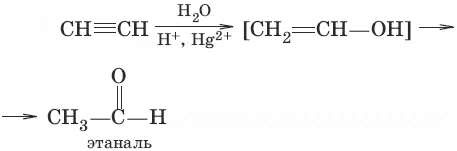
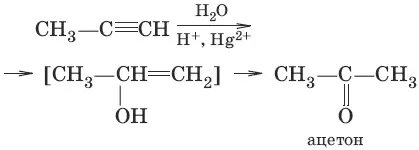
4. (окисление этилена до этаналя)
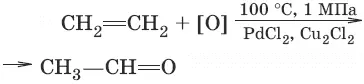
(окисление метана до формальдегида)
CH 4+ O 2→ 400–600 °C, NO → H 2C=O + H 2O
Для карбонильных соединений характерны реакции различных типов: а) присоединение по карбонильной группе; б) восстановление и окисление; в) конденсация; д) полимеризация.
1. (присоединение циановодородной кислоты, образование гидроксинитрилов)
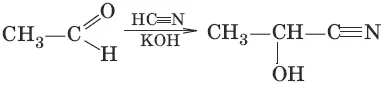
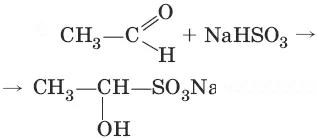
2. (присоединение гидросулбфита натрия)
3. (восстановление)
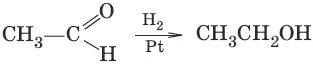
4. (образование полуацеталец и ацеталей)
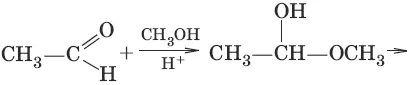
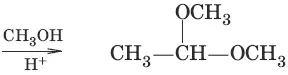
5. (взаимодействие с гидроксоламином, образование оксима ацетальдегида)
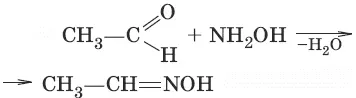
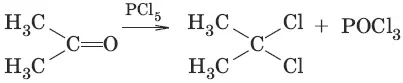
6. (образование дигалогенопроизводных)
7. (α-галогенирование в присутствии OH¯)
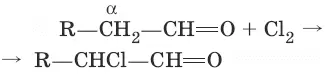
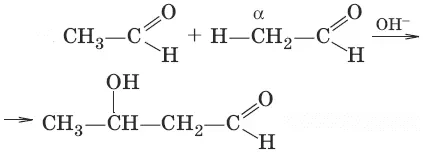
8. (албдольная конденсация)
9. R—CH=O + Ag 2O → NH 3 → R—COOH + 2Ag↓ (окисление, реакция «серебряного зеркала»)
R—CH=O + 2Cu(OH) 2 → R—COOH + Cu 2O↓, + 2H 2O (красный осадок, окисление)
10. (окисление кетонов, жесткие условия)
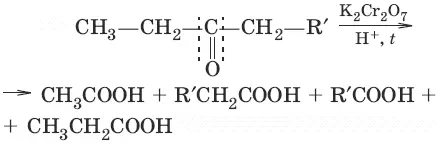
11. n CH 2=O → (—CH2—O—) n параформ n = 8—12 (полимеризация)
11. Карбоновые кислоты и их производные
Карбоновыми кислотами называются органические соединения, содержащие одну или несколько карбоксильных групп —COOH, связанных с углеводородным радикалом. По числу карбоксильных групп кислоты подразделяются на: одноосновные (монокарбоновые) CH 3COOH (уксусная), многоосновные (дикарбоновые, трикарбоновые и т. д.). По характеру углеводородного радикала различают кислоты: предельные (например, CH 3CH 2CH 2COOH); непредельные (CH 2=CH(—COOH); ароматические (С 6Н 5COOH).
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





