М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
4. С 6Н 6+ RCl → AlCl 3 → С 6Н 5—R + HCl (алкилирование)
5. (ацилирование)
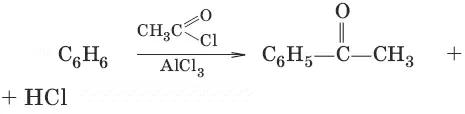
6. С 6Н 6+ ЗН 2→ t, Ni → С 6Н 12циклогексан (присоединение водорода)
7. (1,2,3,4,5,6-гексахлороциклогексан, присоединение хлора)

8. С 6Н 5—CH 3+ [О] → С 6Н 5—COOH кипячение с раствором КMnO 4(окисление алкилбензолов)
7. Галогеноуглеводороды
Галогеноуглеводородами называются производные углеводородов, в которых один или несколько атомов водорода заменены на атомы галогена.
1. CH 2=CH 2+ HBr → CH 3—CH 2Br (гидрогалогенирование ненасыщенных углеводородов)
CH≡CH + HCl → CH 2=CHCl
2. CH 3CH 2OH + РCl 5 → CH 3CH 2Cl + POCl 3+ HCl (получение из спиртов)
CH 3CH 2OH + HCl → CH 3CH 2Cl + Н 2O (в присутствии ZnCl 2, t°C )
3. а) CH 4+ Cl 2 →hv→ CH 3Cl + HCl (галогенирование углеводородов)
б)
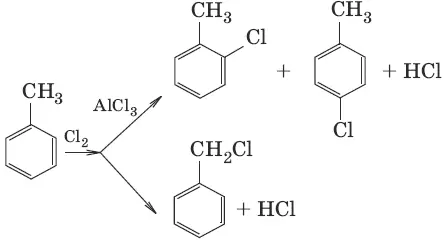
Наибольшее значение для соединений этого класса имеют реакции замещения и отщепления.
1. CH 3CH 2Br + NaOH (водн. р-р) → CH 3CH 2OH + NaBr (образование спиртов)
2. CH 3CH 2Br + NaCN → CH 3CH 2CN + NaBr (образование нитрилов)
3. CH 3CH 2Br + NH 3→ [CH 3CH 2NH 3] +Br ↔— HBr ↔ CH 3CH 2NH 2(образование аминов)
4. CH 3CH 2Br + NaNO 2 → CH 3CH 2NO 2+ NaBr (образование нитросоединений)
5. CH 3Br + 2Na + CH 3Br → CH 3—CH 3+ 2NaBr (реакция Вюрца)
6. CH 3Br + Mg → CH 3MgBr (образование магнийорганических соединений, реактив Гриньяра)
7. (дегидрогалогенирование)
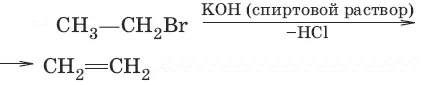
8. Спирты
Спиртами называются производные углеводородов, в молекулах которых содержится одна или несколько гидроксильных групп (—OH), связанных с насыщенными атомами углерода. Группа —OH (гидроксильная, оксигруппа) является в молекуле спирта функциональной группой. Систематические названия даются по названию углеводорода с добавлением суффикса - оли цифры, указывающей положение гидроксигруппы. Нумерация ведется от ближайшего к OH-группе конца цепи.
По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа —OH), многоатомные (две и более групп —OH). Одноатомные спирты: метанол CH 3OH, этанол С 2Н 5OH; двухатомный спирт: этилен-гликоль (этандиол-1,2) HO—CH 2—CH 2—OH; трехатомный спирт: глицерин (пропантриол-1,2,3) HO—CH 2—CH(OH)—CH 2—OH. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты первичные R—CH 2—OH, вторичные R 2CH—OH, третичные R 3C—OH.
По строению радикалов, связанных с атомом кислорода, спирты подразделяются на предельные, или алканолы (CH 3CH 2—OH), непредельные, или алкенолы (CH 2=CH—CH 2—OH), ароматические (С 6Н 5CH 2—OH).
Виды изомерии (структурная изомерия): 1) изомерия положения OH-группы (начиная с С 3); 2) углеродного скелета (начиная с С 4); 3) межклассовая изомерия с простыми эфирами (например, этиловый спирт CH 3CH 2OH и диметиловый эфир CH 3—О—CH 3). Следствием полярности связи О—Н и наличия неподеленных пар электронов на атоме кислорода является способность спиртов к образованию водородных связей.
1. CH 2=CH 2+ Н 2O/Н + → CH 3—CH 2OH (гидратация алкенов)
2. CH 3—CHO + Н 2→ t, Ni → С 2Н 5OH (восстановление альдегидов и кетонов)
3. C 2H 5Br + NaOH (водн.) → С 2Н 5OH + NaBr (гидролиз галогенопроизводных)
ClCH 2—CH 2Cl + 2NaOH (водн.) → HOCH 2—CH 2OH + 2NaCl
4. CO + 2Н 2→ ZnO, CuO, 250 °C, 7 МПа → CH 3OH (получение метанола, промышленность)
5. С 6Н 12O 6→ дрожжи → 2С 2Н 5OH + 2CO 2(брожение моноз)
6. 3CH 2=CH 2+ 2KMnO 4+ 4Н 2O → 3CH 2OH—CH 2OH - этиленгиликоль + 2KOH + 2MnO 2(окисление в мягких условиях)
7. а) CH 2=CH—CH 3+ O 2→ CH 2=CH—CHO + Н 2O
б) CH 2=CH—CHO + Н 2→ CH 2=CH—CH 2OH
в) CH 2=CH—CH 2OH + Н 2O 2→ HOCH 2—CH(OH)—CH 2OH (получение глицерина)
Химические свойства спиртов связаны с наличием в их молекулу группы —OH. Для спиртов характерны два типа реакций: разрыв связи С—О и связи О—Н.
1. 2С 2Н 5OH + 2Na → Н 2+ 2C 2H 5ONa (образование алкоголятов металлов Na, К, Mg, Al)
2. а) С 2Н 5OH + NaOH ≠ (в водном растворе не идет)
б) CH 2OH—CH 2OH + 2NaOH → NaOCH 2—CH 2ONa + 2Н 2O
в) (качественная реакция на многоатомные спирты – образование ярко-синего раствора с гидроксидом меди)
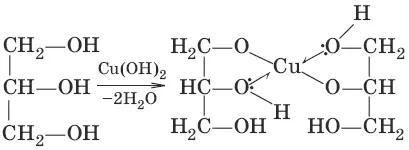
3. а) (образование сложных эфиров)
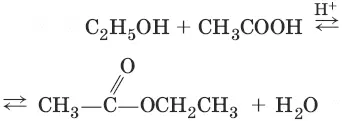
б) С 2Н 5OH + H 2SO 4 → С 2Н 5—О—SO 3H + Н 2O (на холоду)
в)
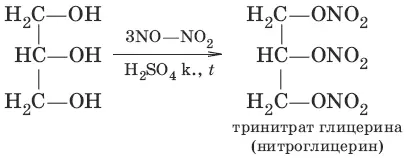
4. а) С 2Н 5OH + HBr → С 2Н 5Br + Н 2O
б) С 2Н 5OH + РCl 5 → С 2Н 5Cl + POCl 3+ HCl
в) С 2Н 5OH + SOCl 2 → С 2Н 5Cl + SO 2+ HCl (замещение гидроксильной группы на галоген)
5. С 2Н 5OH + HOC 2H 5→ H 2SO 4, <140 °C → C 2H 5—O—C 2H 5+ H 2O (межмолекулярная гидротация)
6. С 2Н 5OH → H 2SO 4, 170 °C → CH 2=CH 2+ H 2O (внутримолекулярная гидротация)
7. а) (дегидрирование, окисление первичных спиртов)
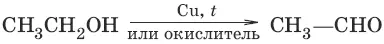
б) (дегидрирование, окисление вторичных спиртов)
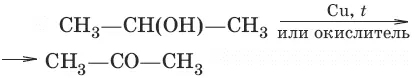
9. Фенолы
Фенолами называются производные аренов, в которых один или несколько атомов водорода ароматического кольца замещены на гидроксильные группы. По числу гидроксильных групп в ароматическом кольце различают одно– и многоатомные (двух– и трехатомные) фенолы. Для большинства фенолов используются тривиальные названия. Структурная изомерия фенолов связана с различным положением гидроксильных групп.
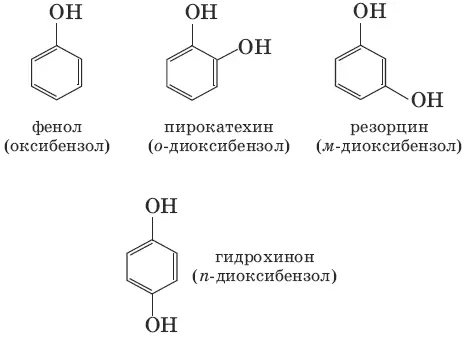
1. С 6Н 5Cl + NaOH(p, 340°C) → С 6Н 5OH + NaCl (щелочной гидролиз галогеноуглеводородов)
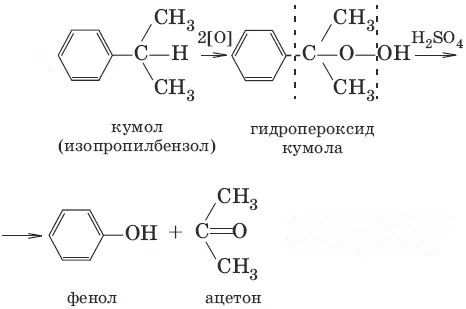
2. (кумольный способ получения)
3. C 6H 5SO 3Na + NaOH (300–350°C) → С 6Н 5OH + Na 2SO 3(щелочное плавление солей ароматических сульфоновых кислот)
Фенолы в большинстве реакций по связи О—Н активнее спиртов, поскольку эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие непо-деленной электронной пары атома кислорода в системе л-сопряжения). Кислотность фенолов значительно выше, чем спиртов.
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





