М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Са(HCO 3) 2+ 2HCl → CaCl 2+ 2Н 2CO 3
Mg(HCO 3) 2+ 2HCl → MgCl 2+ 2H 2CO 3
До начала титрования рН раствора гидрокарбонатов кальция и магния больше 7 за счет гидролиза солей с участием аниона слабой кислоты. В точке эквивалентности раствор имеет слабокислую реакцию, обусловленную диссоциацией слабой угольной кислоты:
Н 2CO 3↔ HCO 3¯ + Н +
Ж вр(Н 2O) = с э(солей) • 1000 (ммоль/л).
Общая жесткость воды (общее содержание ионов кальция и магния) определяется с использованием метода комплексонометрии.
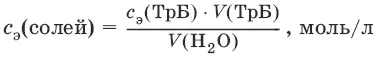
Ж пост(Н 2O) = с э(солей) • 1000 (ммоль/л).
4.5. Методы редоксиметрии
Методы редоксиметрии, в зависимости от используемых титрантов, подразделяются на:
1) перманганатометрию. Титрант – раствор перманганата калия КMnO 4. Индикатор – избыточная капля титранта;
2) иодометрию. Титрант – раствор свободного иода I 2или тиосульфата натрия Na 2S 2O 3. Индикатор – крахмал.
При вычисления молярных масс эквивалентов окислителей и восстановителей исходят из числа электронов, которые присоединяет или отдает в данной реакции молекула вещества. Для нахождения молярной массы эквивалента окислителя (восстановителя) нужно его молярную массу разделить на число принятых (отданных) электронов в данной полуреакции.
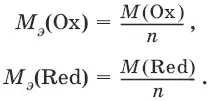
Например, в реакции окисления сульфата железа(II) перманганатом калия в кислой среде:
2KMnO 4+ 10FeSO 4+ 8H 2SO 4= 2MnSO 4+ 5Fe 2(SO 4) 3+ K 2SO 4+ 8H 2O
1 | MnO 4¯ + 8Н ++ 5ē → Mn 2++ 4H 2O
5 | Fe 2+– ē → Fe 3+
ион MnO 4¯ как окислитель принимает пять электронов, а ион Fe 2+как восстановитель отдает один электрон. Поэтому для расчета молярных масс эквивалентов окислителя и восстановителя их молярные массы следует разделить на пять и на один соответственно.
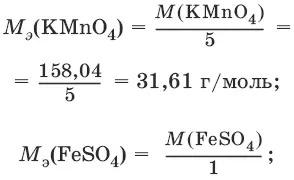
M 3(Fe 2+) = M(Fe 2+) = 55,85 г/моль.
В реакции окисления сульфита натрия перманганатом калия в нейтральной среде:
2KMnO 4+ 3Na 2SO 3+ Н 2O → 2MnO 2+ 3Na 2SO 4+ 2KOH
2 | MnO 4¯ + 2Н 2O + Зē → MnO 2+ 4OH¯
3 | SO 3 2-+ 2OH¯ + 2ē → SO 4 2-+ Н 2O
ион MnO 4¯ принимает только три электрона, а ион восстановителя SO 3 2-отдает два электрона, следовательно:
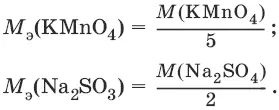
Молярные массы эквивалентов окислителей и восстановителей зависят от условий проведения реакций и определяются, исходя из соответствующих полуреакций.
4.6. Фотоколориметрия
Фотоколориметрия – оптический метод анализа, который рассматривает взаимодействие вещества с электромагнитным излучением в видимой области: длина волны (λ) 380–750 нм; волновое число (v) 2,5 10 4– 1,5 • 10 4см -1; энергия излучения (Е) 1—10 эВ.
Поглощенное световое излучение количественно описывается законом Бугера–Ламберта-Бера:
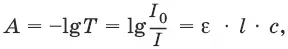
где А – поглощение вещества, или его оптическая плотность; Т – пропускание образца, т. е. отношение интенсивности света, прошедшего через образец, к интенсивности падающего света, I/I 0; с – концентрация вещества (обычно моль/л); l – толщина кюветы (см); ε – молярная поглощательная способность вещества или молярный коэффициент поглощения [л/(моль см)].
Расчет молярного коэффициента поглощения проводят по формуле:
IV. Органическая химия
1. Алканы
Алканы (предельные углеводороды, парафины) – ациклические насыщенные углеводороды общей формулы С n H 2n+2. В соответствии с общей формулой алканы образуют гомологический ряд.
Первые четыре представителя имеют полусистематические названия – метан (CH 4), этан (С 2Н 6), пропан (С 3Н 8), бутан (С 4Н 10). Названия последующих членов ряда строятся из корня (греческие числительные) и суффикса - ан: пентан (С 5Н 12), гексан (С 6Н 14), гептан (С 7Н 16) и т. д.
Атомы углерода в алканах находятся в sp 3 -гибридном состоянии. Оси четырех sp 3- орбиталей направлены к вершинам тетраэдра, валентные углы равны 109°28 .
Пространственное строение метана:
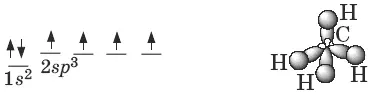
Энергия С—С связи Е с — с = 351 кДж/моль, длина С—С связи 0,154 нм.
Связь С—С в алканах является ковалентной неполярной. Связь С—Н – ковалентная слабополярная.
Для алканов, начиная с бутана, существуют структурные изомеры (изомеры строения), различающиеся порядком связывания между атомами углерода, с одинаковым качественным и количественным составом и молекулярной массой, но различающихся по физическим свойствам.

1. С nH 2n+2→ 400–700 °C → С pH 2p+2+ С mH 2m,
n = m + p.
Крекинг нефти (промышленный способ). Алканы также выделяют из природных источников (природный и попутный газы, нефть, каменный уголь).
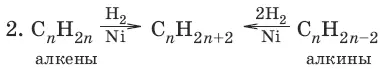
(гидрирование непредельных соединений)
3. nCO + (2n + 1)Н 2 → С nH 2n+2+ nH 2O (получение из синтез-газа (CO + Н 2))
4. (реакция Вюрца)
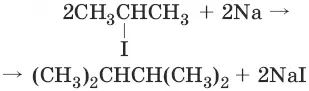
5. (реакция Дюма) CH 3COONa + NaOH → t → CH 4+ Na 2CO 3
6. (реакция Кольбе)
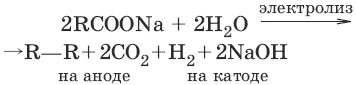
Алканы не способны к реакциям присоединения, т. к. в их молекулах все связи насыщены, для них характерны реакции радикального замещения, термического разложения, окисления, изомеризации.
1. (реакционная способность убывает в ряду: F 2> Cl 2> Br 2> (I 2не идет), R 3C• > R 2CH• > RCH 2• > RCH 3•)
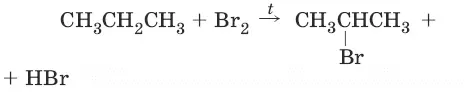
2. (реакция Коновалова)
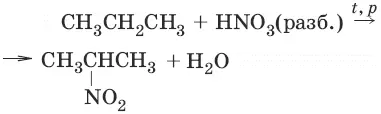
3. C nH 2n+2+ SO 2+ ½O 2→ hν → C nH 2n+1SO 3H – алкилсульфокислота
(сульфоокисление, условия реакции: облучение УФ)
4. CH 4→ 1000 °C → С + 2Н 2; 2CH 4→ t>1500 °C → С 2Н 2+ ЗН 2(разложение метана – пиролиз)
5. CH 4+ 2Н 2O → Ni, 1300 °C → CO 2+ 4Н 2(конверсия метана)
6. 2С nH 2n+2+ (Зn+1)O 2 → 2nCO 2+ (2n+2)Н 2O (горение алканов)
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





