М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
аОх 1+ bRed 1 ↔ аОх 2+ bRed 2протекает в прямом направлении, если ΔЕ 0= Е 0 Ox1/Red2 – Е 0 Ox2/Red1> 0, И В обратном направлении, если ΔЕ 0< 0.
Глубина протекания реакции, т. е. степень превращения исходных веществ в продукты реакции, определяется константой равновесия.
Для окислительно-восстановительной реакции константа равновесия с потенциала-
ми участвующих в реакции редокс-пар связана уравнением:
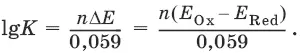
2. Качественные реакции катионов
I группа:Li +, NH 4 +, Na +, K +
групповой реагент – отсутствует.
Свойства соединений: хлориды, сульфаты и гидроксиды растворимы в воде.
II группа:Ag +, Hg 2 2+, Pb 2+
групповой реагент – HCl ( с (HCl) = 2 моль/л).
Свойства соединений: хлориды не растворимы в воде.
III группа:Са 2+, Ва 2+, Sr 2+, Pb 2+
групповой реагент – H 2SO 4( c (H 2SO 4) = 2 моль/л).
Свойства соединений: сульфаты не растворимы в воде.
IV группа:Al 3+, Cr 3+, Zn 2+, As(III), As(IV), Sn 2+
групповой реагент – NaOH ( c (NaOH) = 2 моль/л), избыток.
Свойства соединений: гидроксиды растворимы в избытке NaOH.
V группа:Bi 3+, Fe 2+, Fe 3+, Mn 2+
групповой реагент – NH 3(конц.).
Свойства соединений: гидроксиды нерастворимы в избытке NaOH и NH 3.
VI группа:Cd 2+, Co 2+, Cu 2+, Ni 2+
групповой реагент – NH 4OH (конц.).
Свойства соединений: гидроксиды нерастворимы в избытке NaOH, но растворимы в избытке NH 3.
2.1. I аналитическая группа
1. Реактив, условия: Na 2HPO 4, конц. NH 3.
Уравнение реакции:
3LiCl + Na 2HPO 4= Li 3PO 4↓ + 2NaCl +HCl
Наблюдения: белый осадок.
2. Реактив, условия: Na 2CO 3, рН ≈ 7
Уравнение реакции: 2LiCl + Na 2CO 3= Li 2CO 3↓ + 2NaCl
Наблюдения: белый осадок.
1. Реактив, условия: NaOH, газовая камера.
Уравнение реакции:
NH 4Cl + NaOH = NaCl + Н 2O + NH 3↑
Наблюдения: запах аммиака, фенолфталеиновая бумага краснеет.
2. Реактив, условия: реактив Несслера (смесь K 2[HgI 4] и KOH)
Уравнение реакции:
NH 3+ 2K 2[HgI 4] + ЗKOH = [OHg 2NH 2]I↓ + 7KI + 2Н 2O
Наблюдения: красно-бурый осадок.
1. Реактив, условия: K[Sb(OH) 6], насыщенный раствор, холод, рН ≈ 7, мешают NH 4 +, Li +
Уравнение реакции:
NaCl + K[Sb(OH) 6] = Na[Sb(OH) 6]↓ + KCl
Наблюдения: белый осадок.
2. Реактив, условия: Zn(UO 2) 3(CH 3COO) 8, предметное стекло, CH 3COOH, мешает Li +
Уравнение реакции:
NaCl + Zn(UO 2) 3(CH 3COO) 8+ CH 3COOK + 9Н 2O = NaZn(UO 2) 3(CH 3COO) 9 9Н 2O↓ + KCl
Наблюдения: желтые кристаллы октаэд-рической и тетраэдрической форм.
1. Реактив, условия: Na 3[Co(NO 2) 6], слабо-кислая среда, мешают NH 4 +, Li +.
Уравнение реакции:
2KCl + Na 3[Co(NO 2) 6] = K 2Na[Co(NO 2) 6]↓ + 2NaCl
Наблюдения: желтый осадок.
2. Реактив, условия: NaHC 4H 4O 6, рН ≈ 7, мешает NH 4 +.
Уравнение реакции: 2KCl + NaHC 4H 4O 6= K 2C 4H 4O 6↓ + NaCl + HCl
Наблюдения: белый осадок.
2.2. II аналитическая группа
1. Реактив, условия: HCl, NH 3 • Н 2O
Уравнения реакций:
AgNO 3+ HCl = AgCl↓ + HNO 3
AgCl↓ + 2NH 3 • H 2O = [Ag(NH 3) 2]Cl + 2H 2O
[Ag(NH 3) 2]Cl + 2HNO 3= AgCl↓ + 2NH 4NO 3
Наблюдения: белый осадок, растворимый в избытке аммиака и выпадающий вновь при добавлении азотной кислоты (использовать спец. слив!).
2. Реактив, условия: К 2СrO 4, рН = 6,5–7,5.
Уравнение реакции:
2AgNO 3+ K 2CrO 4= Ag 2CrO 4↓ + 2KNO 3Наблюдения: кирпично-красный осадок.
1. Реактив, условия: HCl, NH 3 • Н 2O
Уравнения реакций:
Hg 2(NO 3) 2+ 2HCl = Hg 2Cl 2↓ + 2HNO 3
Hg 2Cl 2↓ + 2NH 3 • H 2O = [HgNH 2]Cl↓ + Hgi↓ + NH 4Cl + 2H 2O
Наблюдения: белый осадок, при добавлении аммиака – чернеет (использовать спец. слив!).
2. Реактив, условия: Cu (металл.)
Уравнение реакции:
Hg 2(NO 3) 2+ Cu = Hg↓ + Cu(NO 3) 2
Наблюдения: образование амальгамы.
1. Реактив, условия: HCl
Уравнение реакции:
Pb(NO 3) 2+ 2HCl = РЬCl 2↓ + 2HNO 3
Наблюдения: белый осадок, растворимый в горячей воде.
2. Реактив, условия: KI
Уравнение реакции:
РЬCl 2+ 2KI = РCl 2↓ + 2KCl
Наблюдения: ярко-желтый осадок.
2.3. III аналитическая группа
1. Реактив, условия: H 2SO 4
Уравнение реакции:
ВaCl 2+ H 2SO 4= BaSO 4↓ + 2HCl
Наблюдения: белый осадок, нерастворимый в HNO 3.
2. Реактив, условия: К 2СrO 4или К 2Сr 2O 7
Уравнение реакции:
ВaCl 2+ К 2СrO 4= ВаСrO 4↓ + 2KCl
Наблюдения: желтый осадок, нерастворимый в CH 3COOH, растворимый в HNO 3.
1. Реактив, условия: H 2SO 4и С 2Н 5OH
Уравнение реакции:
CaCl 2+ H 2SO 4+ 2Н 2O = CaSO 4 • 2H 2O↓ + 2HCl
Наблюдения: белые кристаллы гипса.
2. Реактив, условия: (NH 4) 2C 2O 4
Уравнение реакции:
CaCl 2+ (NH 4) 2C 2O 4= СаС 2O 4↓ + 2NH 4Cl
Наблюдения: белый осадок, нерастворимый в CH 3COOH, растворимый в HNO 3.
1. Реактив, условия: «гипсовая вода»
Уравнение реакции:
SrCl 2+ CaSO 4→ t → SrSO 4↓ + CaCl 2
Наблюдения: белый осадок.
2.4. IV аналитическая группа
1.Реактив, условия: ализарин С 14Н 6O 2(OH) 2, NH 3• Н 2O (NH 4Cl)
Уравнения реакций:
AlCl 3+ 3NH 3• H 2O = Al(OH) 3↓ + 3NH 4Cl
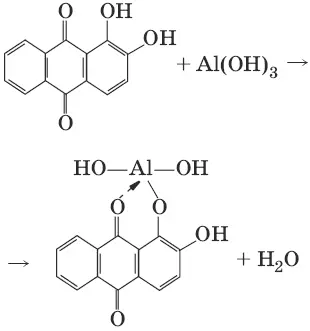
Наблюдения: Розовый лак на фильтровальной бумаге.
2. Реактив, условия: алюминон, CH 3COOH
Уравнение реакции: алюминон с Al(OH) 3образует красный лак, которому приписывается следующая формула:
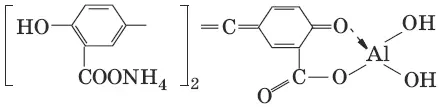
Наблюдения: розовый лак.
Реактив, условия: NaOH, H 2O 2, нагревание, амиловый спирт, H 2SO 4
Уравнение реакции:
2СrCl 3+ 10NaOH + ЗН 2O 2= 2К 2СrO 4+ 6NaCl + 8Н 2O
Наблюдения: желтый раствор, при добавлении амилового спирта, H 2SO 4наблюдается синее кольцо.
Реактив, условия: дитизон С 6Н 5—NH—N=C(SH)—N=N—C 6H 5(дифенилкарбазон), CHCl 3, рН = 2,5-10, мешают Pb 2+, Cd 2+, Sn 2+
Уравнения реакций:
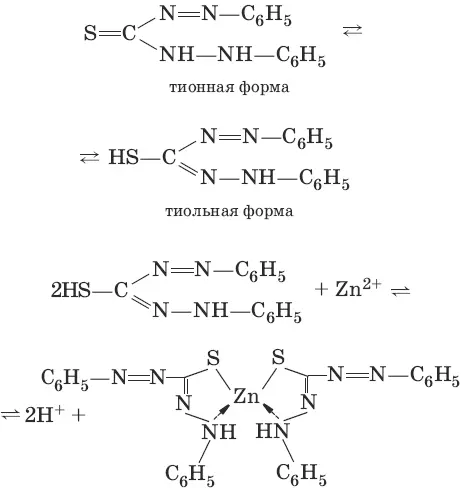
Наблюдения: соль красного цвета, растворимая в хлороформе (CHCl 3).
Реактив, условия: AgNO 3
Уравнение реакции:
Na 3AsO 3+ 3AgNO 3= Ag 3AsO 3↓ + 3NaNO 3
Наблюдения: желтый аморфный осадок, растворим в концентрированном растворе аммиака и в азотной кислоте (использовать спец. слив!).
1. Реактив, условия: магнезиальная смесь (MgCl 2+ NH 4Cl + NH 3), мешает PO 4 3-
Уравнение реакции:
NH 4Cl + MgCl 2+ Na 3AsO 4= NH 4MgAsO 4↓ + 3NaCl
Наблюдения: белый кристаллический осадок (использовать спец. слив!).
2. Реактив, условия: AgNO 3
Уравнение реакции:
Na 3AsO 4+ 3AgNO 3= Ag 3AsO 4↓ + 3NaNO 3
Наблюдения: осадок шоколадного цвета (использовать спец. слив!).
3. Реактив, условия: (NH 4) 2S или H 2S, конц. HCl
Уравнение реакции:
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





