М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
5H 2S + 2Na 3AsO 4+ 6HCl = As 2S 5↓ + 8Н 2O + 6NaCl
Наблюдения: осадок желтого цвета (использовать спец. слив!).
1. Реактив, условия: Bi(NO 3) 3, pH > 7
Уравнения реакций:
SnCl 2+ NaOH = Sn(OH) 2↓ + 2NaCl
Sn(OH) 2+ 2NaOH(изб.) = Na 2[Sn(OH) 4] + 2NaCl
3Na 2[Sn(OH) 4] + 2Bi(NO 3) 3+ 6NaOH = 2Bi + 3Na 2[Sn(OH) 6] + 6NaNO 3
Наблюдения: осадок черного цвета.
2. Реактив, условия: HgCl 2, конц. HCl
Уравнения реакций:
SnCl 2+ 2HCl = H 2[SnCl 4]
H 2[SnCl 4] + 2HgCl 2= H 2[SnCl 6] + Hg 2Cl 2↓
Наблюдения: осадок белого цвета, который постепенно чернеет вследствие образования металлической ртути.
2.5. V аналитическая группа
1. Реактив, условия: Na 2[Sn(OH) 4], pH >7
Уравнение реакции:
2Bi(NO 3) 3+ 3Na 2[Sn(OH) 4] + 6NaOH = 2Bi↓ + 3Na 2[Sn(OH) 6] + 6NaNO 3
Наблюдения: осадок черного цвета.
2. Реактив, условия: KI, рН < 7
Уравнение реакции:
Bi(NO 3) 3+ 3KI = Bil 3↓ + 3KNO 3
Наблюдения: осадок черного цвета, растворяется в избытке KI с образованием оранжевого раствора K[BiI 4]. При разбавлении водой опять выпадает черный осадок BiI 3, который затем гидролизуется с образованием оранжевого осадка ВiOI.
1. Реактив, условия: K 3[Fe(CN) 6]
Уравнение реакции:
FeSO 4+ K 3[Fe(CN) 6] = KFe[Fe(CN) 6]↓ + K 2SO 4
Наблюдения: темно-синий осадок турн-булевой сини.
1. Реактив, условия: K 4[Fe(CN) 6]
Уравнение реакции:
FeCl 3+ K 4[Fe(CN) 6] = KFe[Fe(CN) 6]↓ + ЗKCl
Наблюдения: темно-синий осадок берлинской лазури.
2. Реактив, условия: NH 4CNS, мешают ионы NO 2¯
Уравнение реакции:
FeCl 3+ 3NH 4CNS = Fe(CNS) 3+ 3NH 4Cl
Наблюдения: кроваво-красный раствор.
1. Реактив, условия: NaBiO 3(крист.), HNO 3
Уравнение реакции:
2Mn(NO 3) 2+ 14HNO 3+ 5NaBiO 3= 2HMnO 4+ 5Bi(NO 3) 3+ 5NaNO 3+ 7H 2O
Наблюдения: малиново-фиолетовая окраска раствора.
2.6. VI аналитическая группа
1. Реактив, условия: NH 4OH
Уравнения реакций:
Cd(NO 3) 2+ 2NH 4OH = Cd(OH) 2↓ + 2NH 4NO 3
Cd(OH) 2↓ + 4NH 4OH = [Cd(NH 3) 4](OH) 2+ 2H 2O
Наблюдения: осадок белого цвета, растворим в избытке водного раствора аммиака.
2. Реактив, условия: (NH 4) 2S, pH > 0,5
Уравнение реакции:
Cd(NO 3) 2+ (NH 4) 2S = CdS↓ + 2NH 4NO 3
Наблюдения: желто-оранжевый осадок.
Реактив, условия: NH 4CNS, изоамиловый спирт (смесь изоамилового спирта с эфиром), мешают ионы Fe 3+. Для удаления мешающих ионов Fe 3+добавляют NH 4F.
Уравнение реакции:
СоCl 2+ 4NH 4CNS = (NH 4) 2[Co(SCN) 4] + 2NH 4CNS
Наблюдения: слой органических реагентов окрашен в синий цвет.
Реактив, условия: NH 3Н 2O, избыток
Уравнение реакции:
CuSO 4+ 4NH 3H 2O = [Cu(NH 3) 4]SO 4+ 4Н 2O
Наблюдения: темно-синий раствор.
Реактив, условия: диметилглиоксим C 4H 8N 2O 2(реактив Чугаева), KOH, рН ≈ 9-10
Уравнение реакции:
2C 4H 8N 2O 2+ Ni 2+= Ni(C 4H 6N 2O 2) 2+ 2H +
Наблюдения: розовый осадок.
3. Качественные реакции анионов
Кислотно-основная классификация анионов
I группа:SO 4 2-, CO 3 2-, PO 4 3-, SiO 3 2-
групповой реагент – Ba(NO 3) 2
II группа:CI¯, S 2-
групповой реагент – AgNO 3
III группа:NO 3¯, MoO 4 2-, WO 4 2-, VO 3¯, CH 3COO¯
групповой реагент – отсутствует
3.1. I аналитическая группа
1. Реактив, условия: Ba(NO 3) 2
Уравнение реакции:
SO 4 2-+ Ba(NO 3) 2= BaSO 4↓ + 2NO 3¯
Наблюдения: белый осадок, нерастворим в HNO 3.
1. Реактив, условия: Ba(NO 3) 2
Уравнения реакций:
CO 3 2-+ Ba(NO 3) 2= ВaCO 3↓ + 2NO 3¯
ВaCO 3↓ + 2Н += Ва 2++ CO 2↑ + Н 2O
Наблюдения: белый осадок, легко растворимый в соляной, азотной и уксусной кислотах с выделением оксида углерода(IV) CO 2.
2. Реактив, условия: минеральные кислоты (HCl, HNO 3, H 2SO 4), известковая вода (Са(OH) 2).
Уравнения реакций:
CO 3 2-+ 2H += CO 2↑ + Н 2O
Са(OH) 2+ CO 2= CaCO 3↓ + Н 2O
Наблюдения: выделение газа, помутнение известковой воды.
1. Реактив, условия: Ba(NO 3) 2
Уравнение реакции:
Na 3PO 4+ Ba(NO 3) 2= Ba 3(PO 4) 2↓ + 2NaNO 3
Наблюдения: белый осадок, растворимый в минеральных кислотах.
2. Реактив, условия: молибденовая жидкость, раствор молибдата аммония (NH 4) 2MoO 4в азотной кислоте, NH 4NO 3
Уравнение реакции:
PO 4 3-+ 3NH 4 ++ 12МоO 4 2-+ 24Н += (NH 4) 3[P(Mo 3O 10) 4]↓ + 12Н 2O
Наблюдения: желтый кристаллический осадок.
1. Реактив, условия: разбавленные растворы кислот.
Уравнение реакции:
SiO 3 2-+ 2H += H 2SiO 3↓
Наблюдения: образование геля кремниевой кислоты.
2. Реактив, условия: соли аммония (NH 4Cl, или (NH 4) 2SO 4, или NH 4NO 3).
Уравнение реакции:
SiO 3 2-+ 2NH 4 ++ (2Н 2O) = H 2SiO 3↓ + 2NH 3+ (2Н 2O)
Наблюдения: образование геля кремниевой кислоты.
3.2. II аналитическая группа
Реактив, условия: AgNO 3, NH 4OH, HNO 3.
Уравнения реакций:
Ag ++ CI¯ = AgCl↓
AgCl↓ + 2NH 4OH = [Ag(NH 3) 2]Cl + 2H 2O
[Ag(NH 3) 2]Cl + 2HNO 3= AgCl↓ + 2NH 4NO 3
Наблюдения: белый осадок, растворим в NH 4OH, образуется в HNO 3.
1. Реактив, условия: разбавленные растворы кислот, фильтровальная бумага, смоченная ацетатом свинца РЬ 2(CH 3COО) 2.
Уравнения реакций:
S 2-+ 2Н += H 2S↑
H 2S↑ + Pb 2++ 2CH 3COО¯ = PbS↓ + 2CH 3COOH
Наблюдения: резкий запах, почернение фильтровальной бумаги, смоченной ацетатом свинца.
2. Реактив, условия: соли сурьмы(III), Sb 2S 3
Уравнение реакции:
3S 2-+ 2Sb 3+= Sb 2S 3↓
Наблюдения: оранжевый осадок.
3. Реактив, условия: соли кадмия(II), Cd(NO 3) 2
Уравнение реакции: S 2-+ Cd 2+= CdS↓
Наблюдения: желтый осадок.
3.3. III аналитическая группа
Реактив, условия: дифениламин (C 6H 5) 2NH в H 2SO 4(конц.)
Наблюдения: темно-синее окрашивание на стенках пробирки.
Реактив, условия: дифениламин (C 6H 5) 2NH в H 2SO 4(конц.)
Наблюдения: темно-синее окрашивание на стенках пробирки.
1. Реактив, условия: Н 2O 2, эфир. Уравнение реакции:
VO 3¯ + Н 2O 2= VO 4¯ + Н 2O
Наблюдения: окрашивание органической фазы в оранжевый цвет.
2. Реактив, условия: лигнин (газетная бумага)
Наблюдения: лигнин, содержащийся в газетной бумаге, восстанавливает ион VO 3¯до низших степеней окисления, которые окрашивают газетную бумагу в черно-зеленый цвет.
Реактив, условия: H 2SO 4(конц.)
Уравнение реакции:
CH 3COО¯ + Н += CH 3COOH
Наблюдения: запах уксуса.
4. Количественный анализ
4.1. Титриметрический (объемный) анализ
Молярная концентрация с э= n э/V, где n э – количество вещества эквивалентов, моль; V – объем раствора, л; единица измерения концентрации – моль/л.
Количество вещества эквивалента (n э) n э= m/M э= c э V, где m – масса вещества, г; M э – молярная масса эквивалента, г/моль, V – объем раствора, л.
Закон эквивалентов: n э(А) = n э(В) или
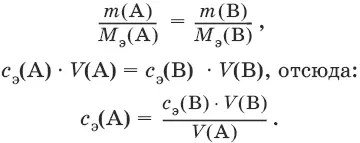
Титр – количество граммов растворенного вещества, содержащегося в 1 мл раствора.
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





