М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
9.1. Хром и его соединения
Хром представляет собой ковкий тягучий металл серо-стального цвета. Электронная формула атома хрома 1s 22s 22p 63s 23p 63d 54s 1.
Характерные степени окисления хрома, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
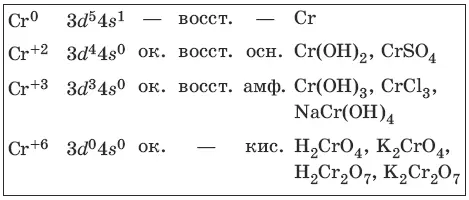
Получение и свойства хрома
FeO • Cr 2O 3+ 4CO → t → Fe + 2Cr + 4CO 2(Fe + 2Cr) – феррохром
Сr 2O 3+ 2Al → t → 2Сr + Al 2O 3– метод алюминотермии
Хром пассивируется на холоду концентрированными азотной и серной кислотами.
Сr + 2HCl = СrCl 2+ Н 2
СrCl 2+ 2NaOH = Cr(OH) 2↓ + 2NaCl
Свойства соединений хрома (+2) и хрома (+3)
Гидроксид хрома(II) сразу окисляется кислородом воздуха.
4Сr(OH) 2+ O 2+ 2Н 2O = 4Сr(OH) 3
СrCl 3+ 3NaOH = Cr(OH) 3↓ + 3NaCl
Cr(OH) 3↓ + 3Na(OH) = Na 3[Cr(OH) 6]
Cr 2O 3+ 2NaOH → t → 2NaCrO 2+ H 2O
Cr(OH) 3↓ + 3HCl = CrCl 3+ 3H 2O
2Cr(OH) 3→ t → Cr 2O 3+ 3H 2O
2CrCl 3+ 3Cl 2+ 16KOH = 2K 2CrO 4+ 12KCl + 8H 2O
2Na 3Cr(OH) 6+ 3Br 2+ 4NaOH = 2Na 2CrO 4+ 6NaBr + 8H 2O
Свойства соединений хрома (+6)
CrO 3+ Н 2O = H 2CrO 4
2CrO 3+ H 2O = H 2Cr 2O 7
Желтый раствор хромата калия устойчив в щелочной среде, оранжевый раствор дихромата калия – в кислой среде.
К 2Сr 2O 7+ 2KOH = 2К 2СrO 4+ Н 2O
2K 2CrO 4+ H 2SO 4= K 2SO 4+ K 2Cr 2O 7+ Н 2O
(NH 4) 2Cr 2O 7 → t → Cr 2O 3+ N 2+ 4Н 2O
Дихромат калия – окислитель в кислой среде.
К 2Сr 2O 7+ 4H 2SO 4+ 3Na 2SO 3= Cr 2(SO 4) 3+ 3Na 2SO 4+ K 2SO 4+ 4H 2O
K 2Cr 2O 7+ 4H 2SO 4+ 3NaNO 2= Cr 2(SO 4) 3+ 3NaNO 3+ K 2SO 4+ 4H 2O
K 2Cr 2O 7+ 7H 2SO 4+ 6KI = Cr 2(SO 4) 3+ 3I 2+ 4K 2SO 4+ 7H 2O
K 2Cr 2O 7+ 7H 2SO 4+ 6FeSO 4= Cr 2(SO 4) 3+ 3Fe 2(SO 4) 3+ K 2SO 4+ 7H 2O
9.2. Марганец и его соединения
Марганец – серебристо-белый твердый и хрупкий металл. Характерные степени окисления марганца, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.

Получение и свойства марганца
FeO • Mn 2O 3+ 4CO → t → Fe + 2Mn + 4CO 2(Fe + 2Mn) – ферромарганец
Mn 2O 3+ 2Al → t → 2Mn + Al 2O 3– метод алюминотермии
Mn + 2HCl = MnCl 2+ Н 2
Mn + 2H 2SO 4(конц.) = MnSO 4+ SO 2+ 2Н 2O
ЗMn + 8HNO 3(разб.) = 3Mn(NO 3) 2+ 2NO + 4Н 2O
Свойства соединений марганца (+2)
MnSO 4+ 2NaOH = Mn(OH) 2↓ + Na 2SO 4
Mn(OH) 2↓ + 2NaOH ≠
Mn(OH) 2↓ + H 2SO 4= MnSO 4+ 2H 2O
2Mn(OH) 2↓ + O 2= MnO 2↓ + 2H 2O
Mn(OH) 2↓ + 2NaOH + Br 2= MnO 2↓ + 2NaBr + 2H 2O
Mn(OH) 2↓ → t → MnO + H 2O↑
2Mn(NO 3) 2+ 16HNO 3+ 5NaBiO 3= 2HMnO 4+ 5Bi(NO 3) 3+ 5NaNO 3+ 7H 2O
3MnCl 2+ 2KClO 3+ 12NaOH → сплавление → 3Na 2MnO 4+ 2KCl + 6NaCl + 6H 2O
Свойства соединений марганца (+4)
MnO 2– устойчивый амфотерный оксид, сильный окислитель.
MnO 2+ 4HCl = MnCl 2+ Cl 2+ 2Н 2O
3MnO 2+ KClO 3+ 6KOH → сплавление → 3K 2MnO 4+ KCl + 3H 2O↑
Свойства соединений марганца (+6)
Соединения устойчивы лишь в сильнощелочной среде.
К 2MnO 4+ 8HCl = MnCl 2+ 2Cl 2+ 2KCl + 4Н 2O
Свойства соединений марганца (+7)
Сильные окислители в кислой среде.
2KMnO 4+ 3H 2SO 4+ 5Na 2SO 3= 2MnSO 4+ 5Na 2SO 4+ K 2SO 4+ 3H 2O
2KMnO 4+ H 2O + 3Na 2SO 3= 2MnO 2+ 3Na 2SO 4+ 2KOH
2KMnO 4+ 2KOH + Na 2SO 3= 2K 2MnO 4+ Na 2SO 4+ H 2O
2KMnO 4+ 8H 2SO 4+ 10FeSO 4= 2MnSO 4+ 5Fe 2(SO 4) 3+ K 2SO 4+ 8H 2O
2KMnO 4+ 8H 2SO 4+ 10KI = 2MnSO 4+ 5I 2+ 6K 2SO 4+ 8H 2O
2KMnO 4+ 3H 2SO 4+ 5NaNO 2= 2MnSO 4+ 5NaNO 3+ K 2SO 4+ 3H 2O
2KMnO 4→ t → K 2MnO 4+ MnO 2+ O 2↑
9.3. Железо и его соединения
Железо является вторым после алюминия металлом по распространенности в природе. Характерные степени окисления железа, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.

Соединения железа (+8) малохарактерны.
Получение и свойства железа
3Fe 2O 3+ CO → t → 2Fe 3O 4+ CO 2
Fe 3O 4+ CO → t → 3FeO + CO 2
FeO + CO → t → Fe + CO 2
3Fe 3O 4+ 8Al → t → 9Fe + 4Al 2O 3
Fe + I 2→ t → FeI 2
2Fe + ЗCl 2→ t → 2FeCl 3
4Fe + 3O 2+ 2Н 2O = 4FeO(OH)↓ (коррозия на воздухе)
Fe + 2HCl = FeCl 2+ Н 2
Fe + H 2SO 4(разб.) = FeSO 4+ H 2
Fe + 4HNO 3(разб.) = Fe(NO 3) 3+ NO + 2H 2O
Концентрированные серная и азотная кислоты пассивируют железо на холоду. При нагревании реакция идет.
2Fe + 6H 2SO 4(конц.) → t → Fe 2(SO 4) 3+ 3SO 2+ 6Н 2O
Fe + 6НNO 3(конц.) → t → Fe(NO 3) 3+ 3NO 2+ 3H 2O
Свойства соединений железа (+2)
FeO + Н 2O ≠
FeO + H 2SO 4= FeSO 4+ H 2O
FeSO 4+ 2NaOH = Fe(OH) 2↓ + Na 2SO 4
Гидроксид железа(II) сразу окисляется кислородом воздуха.
4Fe(OH) 2↓ + 2Н 2O + O 2= 4Fe(OH) 3↓
Fe(OH) 2↓ + H 2SO 4= FeSO 4+ 2Н 2O
Fe(OH) 2↓ + 2NaOH *
FeSO 4+ 6KCN = K 4[Fe(CN) 6] + K 2SO 4
FeSO 4+ K 3[Fe(CN) 6] = KFe[Fe(CN) 6]↓ + K 2SO 4
Свойства соединений железа (+3)
FeCl 3+ 3NaOH = Fe(OH) 3↓ + 3NaCl
Fe(OH) 3↓ + 3HCl = FeCl 3+ 3H 2O
Fe(OH) 3↓ + NaOH ≠ не идет в разбавленном растворе
Fe(OH) 3↓ + NaOH → сплавление → NaFeO 2+ 2H 2O
FeCl 3+ 2HI = 2FeCl 2+ I 2+ 2HCl
FeCl 3+ 6KCN = K 3[Fe(CN) 6] + 3KCl
FeCl 3+ K 4[Fe(CN) 6] = KFe[Fe(CN) 6]↓ + 3KCl
FeCl 3+ 3KCNS = Fe(SCN) 3+ 3KCl
Свойства соединений железа (+6)
Феррат калия – окислитель.
Fe 2O 3+ 3KNO 3+ 4KOH → сплавление → 2K 2FeO 4+ 3KNO 2+ 2H 2O
4K 2FeO 4+ 10H 2SO 4(разб.) = 2Fe 2(SO 4) 3+ 3O 2↑ + 4K 2SO 4+ 10H 2O
9.4. Медь и ее соединения
Медь – мягкий красный металл, хорошо проводит теплоту и электрический ток.
Получение и свойства меди
2CuS + 3O 2→ t → 2CuO + 2SO 2
CuO + CO → t → Cu + CO 2
Cu + 2HCl + Н 2O 2= CuCl 2+ 2Н 2O
Cu + 2H 2SO 4(конц.) = CuSO 4+ SO 2+ 2Н 2O
Cu + 4НЖ) 3(конц.) = Cu(NO 3) 2+ 2NO 2+ 2H 2O
3Cu + 8HNO 3(разб.) = 3Cu(NO 3) 2+ 2NO + 4H 2O
4Cu + O 2(недостаток) → 200 °C → 2Cu 2O
2Cu + O 2(избыток) → 500 °C → 2CuO
2Cu + H 2O + CO 2+ O 2= (CuOH) 2CO 3↓ (малахит)
Свойства соединений меди(I)
2Cu 2O + O 2 → 500 °C → 4CuO
Cu 2O + CO → t → 2Cu + CO 2
Cu 2O + 4(NH 3 • Н 2O) (конц.) = 2[Cu(NH 3) 2]OH + 3H 2O
Свойства соединений меди(II)
CuO + 2HCl = CuCl 2+ Н 2O
CuSO 4+ 2NaOH = Cu(OH) 2↓ + Na 2SO 4
Cu(OH) 2↓ → t → CuO↓ + Н 2O
Cu(OH) 2↓ + H 2SO 4= CuSO 4+ 2H 2O
Cu(OH) 2↓ + NaOH ≠ не идет в растворе
Cu(OH) 2↓ + 2NaOH (конц.) → t → Na 2[Cu(OH) 4]
CuSO 4+ 4(NH 3• H 2O) = [Cu(NH 3) 4]SO 4+ 4Н 2O
[Cu(NH 3) 4]SO 4+ Na 2S = CuS↓ + Na 2SO 4+ 4NH 3
2CuSO 4+ 2H 2O ↔ (CuOH) 2SO 4+ H 2SO 4
2CuSO 4+ 4KI = 2CuI↓ + I 2+ 2K 2SO 4
2Cu(NO 3) 2→ t → 2CuO + 4NO 2+ O 2
9.5. Серебро и его соединения
3Ag + 4HNO 3(разб.) = 3AgNO 3+ NO↑ + 2H 2O
2AgNO 3+ 2NaOH = Ag 2O↓ + H 2O + 2NaNO 3
AgNO 3+ HCl = AgCl↓ + HNO 3
AgCl↓ + 2(NH 3• H 2O) = [Ag(NH 3) 2]Cl + 2H 2O
[Ag(NH 3) 2]Cl + 2HNO 3= AgCl↓ + 2NH 4NO 3
Ag 2O + 4(NH 3 • Н 2O) (конц.) = 2[Ag(NH 3) 2]OH + 3H 2O
2[Ag(NH 3) 2]OH + CH 3CHO + 2H 2O = 2Ag↓ + CH 3COONH 4+ 3(NH 3 • H 2O)
9.6. Цинк и его соединения
Получение и свойства цинка
2ZnS + 3O 2→ t → 2SO 2+ 2ZnO
ZnO + CO → t → Zn + CO 2
Zn + 2HCl = ZnCl 2+ H 2↑
Zn + H 2SO 4(разб.) = ZnSO 4+ H 2↑
4Zn + 5H 2SO 4(конц.) = 4ZnSO 4+ H 2S↑ + 4H 2O
Zn + 4НHNO 3(конц.) = Zn(NO 3) 2+ 2NO 2↑ + 2H 2O
4Zn + 10HNO 3(оч. разб.) = 4Zn(NO 3) 2+ NH 4NO 3+ 3H 2O
Zn + 2NaOH + 2H 2O = Na 2[Zn(OH) 4] + H 2↑
Свойства соединений цинка
ZnSO 4+ 2NaOH = Zn(OH) 2↓ + Na 2SO 4
Zn(OH) 2↓ + H 2SO 4= ZnSO 4+ 2H 2O
Zn(OH) 2↓ + 2NaOH = Na 2[Zn(OH) 4]
Na 2[Zn(OH) 4] + 2HCl = Zn(OH) 2↓ + 2NaCl + 2H 2O
Na 2[Zn(OH) 4] + 4HCl = ZnCl 2+ 2NaCl + 4H 2O
Zn(OH) 2↓ + 6NH 4OH = [Zn(NH 3) 6](OH) 2+ 6H 2O
2ZnSO 4+ 2H 2O ↔ (ZnOH) 2SO 4+ H 2SO 4
III. Аналитическая химия
1. Теоретические основы аналитической химии
Чувствительность аналитической реакции. Предел обнаружения, или открываемый минимум, (m) – наименьшая масса вещества, открываемая данной реакцией по данной методике. Измеряется в микрограммах (1 мкг = 10 – 6 г).
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





