М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
ЗС + СаО → t → СаС 2+ CO
2С + Са → t → СаС 2
ЗС + 4Al → t → Al 4С 3
С + 4НNO 3(конц.) → t → CO 2+ 4NO 2+ 2Н 2O
Свойства оксида углерода (II) – угарного газа
2CO + O 2→ t → 2CO 2
ЗCO + Fe 2O 3→ t → 2Fe + ЗCO 2
CO + CuO → t → Cu + CO 2
CO + H 2O → t, катализатор → CO 2+ Н 2
CO + NaOH → t, p → HCOONa
Свойства оксида углерода(IV) – углекислого газа
CaCO 3+ 2HCl = CaCl 2+ Н 2O + CO 2↑
CaCO 3→ t → СаО + CO 2
CO 2+ Н 2O ↔ Н 2CO 3 ↔ H ++ HCO 3¯ ↔ 2Н ++ CO 3 2-
CO 2+ Са(OH) 2= CaCO 3↓ + Н 2O
CO 2+ Н 2O + CaCO 3↓ = Са(HCO 3) 2
CO 2+ 2Mg → t → С + 2MgO
Свойства карбонатов и гидрокарбонатов
NaOH + CO 2= NaHCO 3
2NaOH + CO 2= Na 2CO 3+ H 2O
Са(HCO 3) 2→ 100 °C → CaCO 3↓ + Н 2O + CO 2↑
CaCO 3→ 1000 °C → СаО + CO 2
2NaHCO 3→ t → Na 2CO 3+ Н 2O + CO 2↑
NaHCO 3+ CH 3COOH = CH 3COONa + Н 2O + CO 2↑
CaCO 3+ Н 2O + CO 2= Са(HCO 3) 2
Са(HCO 3) 2+ Са(OH) 2= CaCO 3↓ + 2Н 2O
Na 2CO 3+ H 2O ↔ NaHCO 3+ NaOH
NaHCO 3+ (Н 2O) ↔ NaOH + (Н 2O) + CO 2
Свойства карбидов
СаС 2+ 2Н 2O = Са(OH) 2+ С 2Н 2
Al 4С 3+ 12HCl = 4AlCl 3+ ЗCH 4
5.2. Получение и свойства кремния и его соединений
Простое вещество
SiO 2+ 2Mg → t → Si + 2MgO
Si + O 2→ t → SiO 2
Si + 2F 2= SiF 4↑
Si + 2Mg → t → Mg 2Si
Si + 2KOH + 2H 2O = K 2SiO 3+ 2H 2
Силан SiH 4
Mg 2Si + 4HCl = 2MgCl 2+ SiH 4↑
SiH 4+ 2O 2= SiO 2+ 2Н 2O (самовоспламенение на воздухе)
Оксид кремния (IV)
SiO 2+ H 2O ≠
SiO 2+ 2NaOH → t, сплавление → Na 2SiO 3+ Н 2O
SiO 2+ 6HF = H 2[SiF 6] + 2H 2O
Кремниевая кислота и силикаты. Кремниевая кислота имеет полимерное строение и состав xSiO 2• yH 2O. H 2SiO 3– условная формула, такого соединения не выделено.
Na 2SiO 3+ 2HCl = H 2SiO 3↓ + 2NaCl
Na 2SiO 3+ 2Н 2O + 2CO 2= 2NaHCO 3+ H 2SiO 3↓
H 2SiO 3→ t → SiO 2+ H 2O
5.3. Получение и свойства соединений олова и свинца
Гидроксиды олова и свинца имеют амфо-терные свойства. При этом в степени окисления элемента +2 в гидроксидах преобладают основные свойства, а в степени окисления +4 – кислотные. Соединения Sn 2+имеют восстановительные свойства, а соединения РЬ 4+– окислительные:
SnCl 2+ 2NaOH = Sn(OH) 2↓ + 2NaCl
Sn(OH) 2↓ + 2HCl = SnCl 2+ 2H 2O
Sn(OH) 2↓ + 2NaOH = Na 2[Sn(OH) 4]
SnCl 4+ 4NH 4OH = H 2SnO 3↓ + 4NH 4Cl + H 2O
H 2SnO 3↓ + 2NaOH + H 2O = Na 2[Sn(OH) 6]
H 2SnO 3↓ + 4HCl = SnCl 4+ 3H 2O
SnCl 2+ 2FeCl 3= 2FeCl 2+ SnCl 4
PbO 2+ 4HCl = PbCl 2+ Cl 2↑ + 2H 2O
6. VA-группa
Элементы VA-группы имеют электронную формулу ns 2np s. Азот, фосфор и мышьяк являются неметаллами, висмут и сурьма имеют металлические свойства. Наиболее характерные степени окисления: +5, +3, 0, -3. Оксиды Э 2O 5имеют кислотные свойства, свойства оксидов Э 2O 3: кислотные – для N и Р, амфотерные – для As и Sb, основные – для Bi.
6.1. Получение и свойства азота и его соединений
Характерные степени окисления азота, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице.
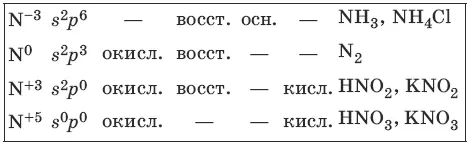
Простое вещество
NH 4NO 2→ t → N 2+ 2H 2O
N 2+ 6Li = 2Li 3N
N 2+ 3Ca → t → Ca 3N 2
N 2+ O 2→ t → 2NO
Соединения азота (-3)
N 2+ ЗН 2 → t, p, катализатор → 2NH 3
Ca 3N 2+ 6H 2O = ЗСа(OH) 2+ 2NH 3
2NH 4Cl + Са(OH) 2→ t → CaCl 2+ 2NH 3+ 2Н 2O
NH 3+ Н 2O ↔ NH 3• Н 2O ↔ NH 4 ++ OH¯
NH 3+ HCl = NH 4Cl
4NH 3+ CuSO 4= [Cu(NH 3) 4]SO 4
2NH 3• H 2O + AgCl = [Ag(NH 3) 2]Cl + 2H 2O
4NH 3• H 2O + Ag 2O = 2[Ag(NH 3) 2]OH + 3H 2O
4NH 3+ 3O 2= 2N 2+ 6H 2O
4NH 3+ 5O 2→ Pt, t → 4NO + 6H 2O
2NH 3+ 3CuO → t → 3Cu + N 2+ 3H 2O
NH 4Cl + NaOH = NaCl + NH 3+ H 2O
NH 4Cl → t → NH 3+ HCl
NH 4NO 2→ t → N 2+ 2H 2O
(NH 4) 2CO 3→ t → 2NH 3+ H 2O + CO 2
NH 4NO 3→ t → N 2O + 2H 2O
NH 4NO 2→ t → N 2+ 2H 2O
(NH 4) 2Cr 2O 7→ t → N 2+ Cr 2O 3+ 4H 2O
Оксиды азота
2N 2O → t → 2N 2+ O 2
2HNO 2= NO 2+ NO + H 2O
2NO 2+ Н 2O(хол.) = HNO 2+ HNO 3
2NO 2+ 2NaOH = NaNO 3+ NaNO 2+ H 2O
3NO 2+ H 2O(rop.) = 2HNO 3+ NO
4NO 2+ O 2+ 2H 2O = 4HNO 3
N 2O 3= NO + NO 2
2N 2O 5= 2NO 2+ O 2
N 2O 5+ H 2O = 2HNO 3
N 2O 5+ 2NaOH = 2NaNO 3+ H 2O
Соединения азота (+3)
Ba(NO 2) 2+ H 2SO 4(разб.) = BaSO 4↓ + 2HNO 2(на холоду)
NO 2+ NO + H 2O = 2HNO 2(на холоду)
2HNO 2= NO 2+ NO + H 2O
2HNO 2+ 2HI = I 2+ 2NO + 2H 2O
5NaNO 2+ 3H 2SO 4+ 2KMnO 4= 2MnSO 4+ 5NaNO 3+ K 2SO 4+ 3H 2O
2NaNO 2+ 2H 2SO 4+ 2KI = I 2+ 2NO + K 2SO 4+ Na 2SO 4+ 2H 2O
Соединения азота (+5)
N 2+ 3H 2→ t, p, катализатор → 2NH 3
4NH 3+ 5O 2→ Pt, t → 4NO + 6H 2O
2NO + O 2= 2NO 2
4NO 2+ O 2+ 2H 2O = 4HNO 3
NaNO 3+ H 2SO 4(конц.) = HNO 3 + NaHSO 4
4HNO 3 → hv → 4NO 2+ O 2+ 2H 2O
Cu + 4HNO 3(конц.) = Cu(NO 3) 2+ 2NO 2 + 2H 2O
3Cu + 8HNO 3(разб.) = 3Cu(NO 3) 2+ 2NO + 4H 2O
4Ca + 10HNO 3(конц.) = 4Ca(NO 3) 2+ N 2O + 5H 2O
4Са + 10HNO 3(разб.) = 4Ca(NO 3) 2+ NH 4NO 3+ 3H 2O
HNO 3(конц.) пассивирует на холоду Al, Fe, Cr.
Fe + 6HNO 3(конц.) → t → Fe(NO 3) 3+ 3NO 2+ 3H 2O
Fe + 4HNO 3(разб.) = Fe(NO 3) 3+ NO + 2H 2O
ЗР + 5HNO 3(разб.) + 2Н 2O = 3H 3PO 4+ 5NO
S + 6HNO 3(конц.) = H 2SO 4+ 6NO 2+ 3H 2O
2KNO 3→ t → 2KNO 2+ O 2(металлы до Mg в ряду напряжений)
2Cu(NO 3) 2→ t → 2CuO + 4NO 2+ O 2(металлы от Mg до Cu)
2AgNO 3→ t → 2Ag + 2NO 2+ O 2(металлы после Cu в ряду напряжений)
4Fe(NO 3) 2→ t → 2Fe 2O 3+ 8NO 2+ O 2
6.2. Получение и свойства фосфора и его соединений
Простое вещество (Р 4– белый фосфор, Р – красный фосфор)
2Са 3(PO 4) 2+ 10C + 6SiO 2→ t → Р 4+ 6CaSiO 3+ 10CO
4Р + 5O 2→ t → Р 4О 10
Р 4+ 6Са → t → 2Са 3Р 2
Фосфин РН 3
Zn 3P 2+ 6HCl = 2PH 3↑ + 3ZnCl 2
Са 3Р 2+ 6Н 2O = 2PH 3↑ + 3Ca(OH) 2
2РН 3+ 2O 2= Н 3PO 4
РН 3+ HI= PH 4I (на холоду)
Фосфористая кислота Н 3PO 3(Н 2РHO 3– двухосновная кислота)
Р 4O 6+ 6Н 2O = 4Н 3PO 3
Н 3PO 3+ NaOH = NaH 2PO 3+ H 2O (NaHPHO 3– кислая соль)
Н 3PO 3+ 2NaOH = Na 2HPO 3+ H 2O (Na 2PHO 3– средняя соль)
Фосфорные кислоты: метафосфорная НPO 3(Н n (PO 3) n , где n = 3, 4), дифосфорная – Н 4Р 2O 7, ортофосфорная – Н 3PO 4.
Р 4+ 5O 2= Р 4О 10
Р 4О 10→ Н 2O, 0 °C → НPO 3 → Н 2O, 20 °C → Н 4Р 2O 7→ Н 2O, 10 °C → Н 3PO 4
Н 3PO 4→ t → Н 4Р 2O 7→ t → НPO 3
Н 3PO 4+ NH 3= NH 4H 2PO 4
Н 3PO 4+ NaOH = NaH 2PO 4+ H 2O
Н 3PO 4+ 2NaOH = Na 2HPO 4+ 2H 2O
Н 3PO 4+ 3NaOH = Na 3PO 4+ 3H 2O
Ca 3(PO 4) 2+ 3H 2SO 4= 3CaSO 4+ 2H 3PO 4
Са 3(PO 4) 2+ 2H 2SO 4= Са(Н 2PO 4) 2+ 2CaSO 4
2Са 3(PO 4) 2+ 10C + 6SiO 2→ t → Р 4+ 6CaSiO 3+ 10CO
7. VIA-группа
VIA-группу образуют четыре неметалла: кислород, сера, селен, теллур, называемые халькогенами, и радиоактивный металл полоний. Атомы элементов VIA-группы имеют электронную формулу ns 2np 4. Для них характерны степени окисления -2, 0, +4, +6. У атома кислорода отсутствуют 2d -орбитали, поэтому его валентность равна двум. Наличие d -орбиталей у атомов других элементов позволяет им иметь валентности два, четыре или шесть.
7.1. Кислород и его соединения
Кислород – самый распространенный элемент земной коры. Кислород представляет собой газ без цвета, без вкуса, без запаха. Возможные степени окисления кислорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.

Получение и свойства кислорода
Кислород может быть получен при сжижении и разделении воздуха.
2КMnO 4→ t → К 2MnO 4+ MnO 2+ O 2
2KClO 3→ t → 2KCl + 3O 2
(NaOH) + 2Н 2O → электролиз раствора → 2Н 2+ O 2
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





