М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Несолеобразующие (безразличные) оксиды: CO, SiO, NO, N 2O.
Солеобразующие оксиды:
основные – оксиды металлов в степени окисления +1, +2,
амфотерные – оксиды металлов в степени окисления +2, +3, +4,
кислотные – оксиды металлов в степени окисления +5, +6, +7 и
оксиды неметаллов в степени окисления +1 – +7.
Горение простых веществ:
С + O 2= CO 2
2Са + O 2= 2СаО
Горение (обжиг) сложных веществ:
CH 4+ 2O 2= CO 2+ 2Н 2O
4FeS 2+ 11O 2= 2Fe 2O 3+ 8SO 2
Разложение сложных веществ:
CaCO 3 → t → СаО + CO 2
2Fe(OH) 3→ t → Fe 2O 3+ ЗН 2O
Основным оксидам (Na 2O, CaO, CuO, FeO) соответствуют основания.
СаО + Н 2O = Са(OH) 2(растворимы оксиды металлов IA– и IIА-групп, кроме Be, Mg)
CuO + Н 2O ≠ (оксиды остальных металлов нерастворимы)
СаО + CO 2= CaCO 3
СаО + 2HCl = CaCl 2+ Н 2O
Кислотным оксидам(CO 2, Р 2O 5, СrO 3, Mn 2O 7) соответствуют кислоты.
SO 2+ Н 2O = H 2SO 3(кислотные оксиды, кроме SiO 2, растворимы в воде)
SO 2+ СаО = CaSO 3
SO 2+ 2NaOH = Na 2SO 3+ Н 2O
Амфотерным оксидам(ZnO, Al 2O 3, Cr 2O 3, ВеО, РЬО) соответствуют амфотерные гидроксиды.
ZnO + H 2O ≠ (амфотерные оксиды нерастворимы в воде)
ZnO + 2HCl = ZnCl 2+ Н 2O
ZnO + 2NaOH → t → Na 2ZnO 2+ Н 2O (при нагревании или сплавлении)
ZnO + 2NaOH + H 2O = Na 2[Zn(OH) 4] (в разбавленном растворе)
1.2. Основания
Основания– сложные вещества, состоящие из атомов металла и гидроксиль-ных групп; основания – электролиты, образующие при диссоциации в качестве анионов только анионы гидроксила.
Номенклатура: Fe(OH) 3– гидроксид железа(III).
– растворимые (щелочи) NaOH, KOH;
– нерастворимые Fe(OH) 2, Mg(OH) 2;
– амфотерные Zn(OH) 2, Al(OH) 3, Ве(OH) 2, Сr(OH) 3;
– однокислотные NaOH, KOH;
– двухкислотные Ва(OH) 2, Zn(OH) 2;
– трехкислотные Al(OH) 3, Сr(OH) 3.
Получение щелочей:
2Na + 2Н 2O = 2NaOH + Н 2
Na 2O + Н 2O = 2NaOH
Получение нерастворимых и амфотер-ных оснований:
FeSO 4+ 2NaOH = Fe(OH) 2↓ + Na 2SO 4
AlCl 3+ 3NaOH = Al(OH) 3↓ + 3NaCl
NaOH → Na ++ OH¯ (α = 1, фенолфталеин – красный)
NaOH + HCl = NaCl + H 2O (реакция нейтрализации )
2NaOH + CO 2= Na 2CO 3+ H 2O
2NaOH + Zn(OH) 2= Na 2[Zn(OH) 4]
2NaOH + Al 2O 3→ t → 2NaAlO 2+ H 2O
2NaOH + CuSO 4= Cu(OH) 2↓ + Na 2SO 4
2NaOH + Zn + 2H 2O = Na 2[Zn(OH) 4] + H 2
2NaOH + 2Al + 6H 2O = 2Na[Al(OH) 4] + 3H 2
2NaOH + Si + H 2O = Na 2SiO 3+ 2H 2
Fe(OH) 2 ↔ FeOH ++ OH¯ (α << 1);
FeOH + ↔ Fe 2++ OH‾ (α << 1)
Fe(OH) 2+ H 2SO 4= FeSO 4+ 2H 2O
Fe(OH) 2→ t → FeO + H 2O
Al 3++ ЗOH¯ + Н 2O ↔ Al(OH) 3↓ + Н 2O ↔ [Al(OH) 4]¯ + Н +
Al(OH) 3+ ЗHCl = AlCl 3+ ЗН 2O
Al(OH) 3+ NaOH = Na[Al(OH) 4]
2Al(OH) 3→ t → Al 2O 3+ ЗН 2O
1.3. Кислоты
Кислоты– сложные вещества, состоящие из атомов водорода и кислотного остатка; кислоты – электролиты, образующие при диссоциации в качестве катионов только катионы водорода.
Номенклатура кислот и кислотных остатков:
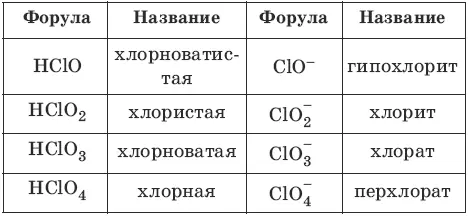
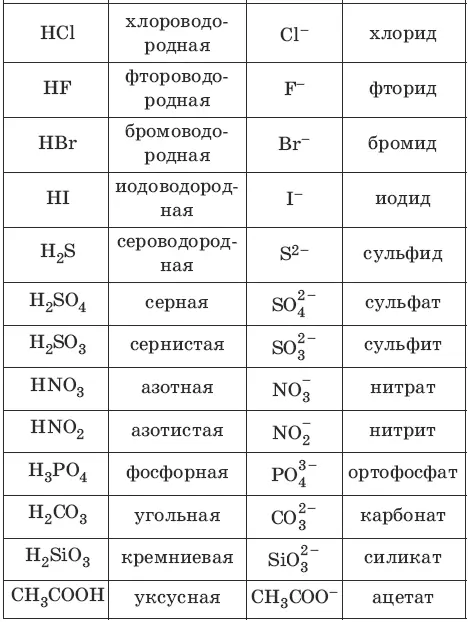
– одноосновные HCl
– двухосновные H 2S
– трехосновные Н 3PO 4
– кислородсодержащие HNO 3
– бескислородные HCl
CO 2+ Н 2O = Н 2CO 3(кроме SiO 2)
Na 2SiO 3+ H 2SO 4= Na 2SO 4+ H 2SiO 3↓
H 2+ Cl 2= 2HCl
HCl → H ++ CI¯ (α =1) (лакмус – красный)
CH 3COOH ↔ CH 3COO¯ + H +(α << 1)
Fe + 2HCl = FeCl 2+ H 2(металл в ряду напряжений до Н)
Cu + HCl ≠ (не идет, металл в ряду напряжений после Н)
2HCl + CuO = CuCl 2+ Н 2O
2HCl + Cu(OH) 2= CuCl 2+ 2Н 2O
2HCl + ZnO = ZnCl 2+ Н 2O
3HCl + Al(OH) 3= AlCl 3+ 3Н 2O
2HCl + Na 2CO 3= 2NaCl + H 2O + CO 2↑ (выделяется газ)
HCl + AgNO 3= AgCl↓ + HNO 3(образуется осадок)
1.4. Соли
Соли– сложные вещества, состоящие из атомов металла и кислотного остатка.
Соли– электролиты, образующие при диссоциации катионы металла или аммония и анионы кислотного остатка.
Na 2HPO 4– гидрофосфат натрия
Са(Н 2PO 4) 2– дигидрофосфат кальция
AlOHSO 4– гидроксид сульфат алюминия
KMgF 3– фторид калия магния
NaCl • NaF – фторид хлорид натрия
NaNH 4HPO 4– гидрофосфат аммония натрия
Na 2[Zn(OH) 4] – тетрагидроксоцинкат натрия
– средние – MgCl 2, Na 3PO 4
– кислые – Na 2HPO 4, Ca(H 2PO 4) 2
– основные – MgOHCl, (Al(OH) 2) 2SO 4
– смешанные – NaCl • NaF, CaBrCl
– двойные – KMgF 3, KAl(SO 4) 2
– комплексные – Na 2[Zn(OH) 4], K 3[Cr(OH) 6]
– кристаллогидраты – CuSO 4• 5H 2O
Cu + 2H 2SO 4 конц= CuSO 4+ SO 2+ 2H 2O
Cu + 2AgNO 3= Cu(NO 3) 2+ 2Ag
CuO + H 2SO 4= CuSO 4+ H 2O
CuO + SO 3= CuSO 4
Cu(OH) 2+ H 2SO 4= CuSO 4+ 2H 2O
CuCO 3+ H 2SO 4= CuSO 4+ H 2O + CO 2
CuCl 2+ Ag 2SO 4= CuSO 4+ 2AgCl↓
NaHCO 3 → Na ++ HCO 3¯ (α = 1)
HCO 3¯ ↔ H ++ CO 3 2-(α << 1)
MgOHCl → MgOH ++ CI¯ (α = 1)
MgOH + ↔ Mg 2++ OH¯ (α << 1)
NaHSO 4 → Na ++ Н ++ SO 4¯ (α = 1)
CuSO 4+ Fe = Cu + FeSO 4(Fe до Cu в ряду напряжений)
Pb + ZnCl 2 ≠ (Pb после Zn в ряду напряжений)
CuSO 4+ 2NaOH = Cu(OH) 2↓ + Na 2SO 4(осадок)
CuSO 4+ H 2S = CuS↓ + H 2SO 4(осадок)
CuSO 4+ BaCl 2= BaSO 4↓ + CuCl 2(осадок)
Ca(HCO 3) 2→ t → CaCO 3↓ + H 2O + CO 2(при кипячении воды)
CaCO 3→ t → CaO + CO 2(роме устойчивых карбонатов щелочных металлов)
2NaNO 3 → t → 2NaNO 2+ O 2(металл до Mg в ряду напряжений)
2Pb(NO 3) 2→ t → 2РbO + 4NO 2+ O 2(металл от Mg до Cu в ряду напряжений)
2AgNO 3→ t → 2Ag + 2NO 2+ O 2(металл после Cu в ряду напряжений)
NH 4Cl → t → NH 3+ HCl (при охлаждении идет в противоположном направлении)
NH 4NO 3→ t → N 2O + 2Н 2O (получение «веселящего» газа)
NH 4NO 2→ t → N 2+ 2H 2O (получение азота в лаборатории)
(NH 4) 2Cr 2O 7→ t → N 2+ Cr 2O 3+ 4Н 2O (реакция «вулкан»)
4KClO3 → 400 °C → KCl + 3KClO 4
2KClO3 → t, MnO 4 → 2KCl + 3O 2
2КMnO 4→ t → К 2MnO 4+ MnO 2+ O 2
Металл ↔ основный оксид ↔ основание ↔ соль
Неметалл ↔ кислотный оксид ↔ кислота ↔ соль
2. IА-группа
Атомы этих элементов имеют электронную формулу ns 1 . Они являются сильными восстановителями. Их активность растет от лития к цезию. Для них характерна степень окисления +1. В природе щелочные металлы находятся в виде хлоридов, сульфатов, карбонатов, силикатов и т. д.
Щелочные металлы мягкие, легко режутся ножом, на свежем срезе имеют серебристую окраску. Все они легкие и легкоплавкие металлы с хорошей электропроводностью. В парообразном состоянии атомы щелочных металлов образуют молекулы Э 2, например Na 2.
2.1. Получение и химические свойства щелочных металлов
Получение
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





