М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
2NaCl → электролиз расплава → 2Na + Cl 2
KCl + Na → 800ºС → К + NaCl
Горение в кислороде
4Li + O 2→ t → 2Li 2O
2Na + O 2→ t → Na 2O 2
К + O 2→ t → KO 2
Реакции с другими неметаллами
2Na + Cl 2= 2NaCl
2Na + H 2→ t → 2NaH
2К + S = K 2S
6Li + N 2= 2Li 3N
Реакции с водой и разбавленными кислотами
2Na + 2Н 2O = 2NaOH + H 2↑
2Na + 2HCl = 2NaCl + H 2↑
2.2. Получение и химические свойства соединений щелочных металлов
Оксиды. Оксиды щелочных металлов являются активными основными оксидами.
4Li + O 2→ t → 2Li 2O
Na 2O 2+ 2Na → t → 2Na 2O
Na 2O + Н 2O = 2NaOH
Na 2O + CO 2= Na 2CO 3
Na 2O(тв) + Al 2O 3(тв) → t → 2NaAlO 2
Na 2O + 2HCl = 2NaCl + H 2O
Гидроксиды. Гидроксиды щелочных металлов – растворимые основания, щелочи. Их степень диссоциации увеличивается от LiOH к CsOH.
NaOH → Na ++ OH¯ (α ≈ 1)
2NaOH + CO 2= Na 2CO 3+ Н 2O
2NaOH + H 2SO 4= Na 2SO 4+ 2H 2O
2NaOH + Zn + 2H 2O = Na 2[Zn(OH) 4] + H 2
2NaOH + ZnO → t → Na 2ZnO 2+ H 2O
NaOH + Al(OH) 3= Na[Al(OH) 4]
3NaOH + FeCl 3= Fe(OH) 3↓ + 3NaCl
Гидриды. Гидриды щелочных металлов – восстановители.
NaH + Н 2O = NaOH + Н 2
NaH + HCl = NaCl + H 2
NaH + Cl 2→ t → NaCl + HCl
Пероксиды и надпероксиды. Являются окислителями.
Na 2O 2+ 2Н 2O = 2NaOH + H 2O 2
Na 2O 2+ 2HCl = 2NaCl + H 2O 2
2Na 2O 2+ 2CO 2= 2Na 2CO 3+ O 2
Na 2O 2+ 2KI + 2H 2SO 4= Na 2SO 4+ I 2 + K 2SO 4+ 2H 2O
Na 2O 2+ CO → t → Na 2CO 3
2KO 2+ 2H 2O = 2KOH + H 2O 2+ O 2
2KO 2+ CO → t → K 2CO 3+ O 2
Соли. Хорошо растворяются в воде. Соли лития окрашивают пламя горелки в карминово-красный цвет, соли натрия – в желтый цвет, соли калия – в светло-фиолетовый цвет. Соли щелочных металлов со слабыми кислотами гидролизуются, создавая щелочную среду.
Na 2CO 3+ H 2O ↔ NaHCO 3+ NaOH
2Na ++ CO 3 2-+ H 2O ↔ CO 3¯ + OH¯ + 2Na +
CO 3 2-+ H 2O ↔ CO 3¯ + OH¯
3. IIА-группа
Элементы IIА-группы имеют электронную формулу ns 2 . Все они являются металлами, сильными восстановителями, несколько менее активными, чем щелочные металлы. Для них характерна степень окисления +2 и валентность II. Щелочноземельные металлы: Са, Sr, Ba, Ra. В природе элементы IIА-группы находятся в виде солей: сульфатов, карбонатов, фосфатов, силикатов. Элементы IIА-группы представляют собой легкие серебристые металлы, более твердые, чем щелочные металлы.
3.1. Получение и химические свойства простых веществ
Элементы IIА-группы – менее активные восстановители, чем щелочные металлы. Их восстановительные свойства увеличиваются от бериллия к радию. Кислород воздуха окисляет Са, Sr, Ba, Ra при обычной температуре. Mg и Be покрыты оксидными пленками и окисляются кислородом только при нагревании:
CaCl 2 → электролиз расплава → Са + Cl 2
2Са + O 2→ t → 2СаО
2Mg + O 2→ t → 2MgO
Са + Cl 2= CaCl 2
Са + Н 2→ t → СаН 2
Са + 2С → t → СаС 2
Са + 2Н 2O = Са(OH) 2+ H 2↑
Mg + 2Н 2O(хол.) ≠
Mg + 2Н 2O(гор.) → t → Mg(OH) 2+ H 2↑
Mg + 2HCl = MgCl 2+ H 2↑
4Mg + 10HNO 3(pазб.) = 4Mg(NO 3) 2+ NH 4NO 3+ 3H 2O
3.2. Получение и химические свойства соединений
Оксиды
Оксид бериллия – амфотерный оксид. Оксид магния – нерастворимый основный оксид. Оксид кальция – растворимый основный оксид.
CaCO 3→ t → СаО + CO 2
2Са + O 2→ t → 2СаО
ВеО + Н 2O ≠
ВеО + 2HCl = ВeCl 2+ Н 2O
ВеО + 2NaOH → t → Na 2BeO 2+ Н 2O
MgO + Н 2O ≠
MgO + 2HCl = MgCl 2+ Н 2O
MgO + NaOH ≠
СаО + Н 2O = Са(OH) 2
СаО + CO 2= CaCO 3
СаО + 2HCl = CaCl 2+ Н 2O
Гидроксиды
Гидроксид бериллия – амфотерное основание. Гидроксид магния – нерастворимое основание. Гидроксиды щелочноземельных металлов – щелочи.
Ве(OH) 2↓ + 2HCl = ВeCl 2+ 2Н 2O
Ве(OH) 2↓ + 2NaOH = Na 2[Be(OH) 4]
Ве(OH) 2→ t → ВеО + Н 2O
Mg(OH) 2↓+ 2HCl = MgCl 2+ 2Н 2O
Mg(OH) 2↓ + NaOH ≠
Mg(OH) 2→ t → MgO + H 2O
Ba(OH) 2+ 2HCl = BaCl 2+ 2H 2O
Ba(OH) 2+ CO 2= BaCO 3↓ + H 2O
Ba(OH) 2+ H 2SO 4= BaSO 4↓ + 2H 2O
Гидриды
Имеют восстановительные свойства.
СаН 2+ 2Н 2O = Са(OH) 2+ 2Н 2
СаН 2+ 2HCl = CaCl 2+ 2Н 2
Пероксиды
ВaO 2+ 2Н 2O = Ва(OH) 2+ Н 2O 2
ВaO 2+ 2HCl = ВaCl 2+ Н 2O 2
2ВaO 2+ 2CO 2= 2ВaCO 3+ O 2
Соли
Содержание ионов Са 2+и Mg 2+обуславливает жесткость воды: временную, если есть гидрокарбонаты Са и Mg, и постоянную, если в воде есть хлориды или сульфаты Са и Mg.
CaCl 2+ Na 2CO 3= CaCO 3↓ + 2NaCl
Са(HCO 3) 2+ Са(OH) 2= 2CaCO 3↓ + 2Н 2O
Са(HCO 3) 2→ t → CaCO 3↓ + Н 2O + CO 2↑
CaCO 3↓ + H 2O + CO 2= Са(HCO 3) 2
CaCO 3+ 2HCl = CaCl 2+ Н 2O + CO 2↑
4. IIIА-группа
Элементы IIIА-группы имеют электронную формулу ns 2np 1. Они являются значительно менее активными восстановителями, чем щелочноземельные металлы. Для них характерна степень окисления +3 и валентность III. В группе сверху вниз возрастают металлические свойства элементов, увеличиваются восстановительные свойства их атомов. Увеличиваются основные свойства гидроксидов и уменьшаются их кислотные свойства.

Соединения Тl 3+являются сильными окислителями и восстанавливаются до соединений Тl +.
4.1. Химические свойства бора и его соединений
4В + 3O 2→ t → 2В 2O 3
В 2O 3+ ЗН 2O = 2Н 3ВO 3
Н 3ВO 3→ t → HBO 2→ t → Н 2В 4O 7→ t → В 2O 3
4Н 3ВO 3+ 2NaOH = Na 2B 4O 7+ 7H 2O
Na 2B 4O 7+ H 2SO 4+ 5H 2O = Na 2SO 4 + 4Н 3ВO 3
B(OH) 3+ 3C 2H 5OH → H 2SO 4(конц.) → B(OC 2H 5) 3+ 3H 2O
4.2. Химические свойства алюминия и его соединений
2Al 2O 3→ электролиз расплава → 4Al + 3O 2
4Al + 3O 2= 2Al 2O 3(металл покрыт оксидной пленкой)
2Al + 6Н 2O = 2Al(OH) 3+ ЗН 2(без оксидной пленки)
2Al + 6HCl = 2AlCl 3+ ЗН 2
2Al + 2NaOH + 6Н 2O = 2Na[Al(OH) 4] + ЗН 2
8Al + 3Fe 3O 4→ t → 9Fe + 4Al 2O 3
Оксид алюминия – амфотерный оксид
Al 2O 3+ Н 2O ≠
Al 2O 3+ 6HCl = 2AlCl 3+ ЗН 2O
Al 2O 3+ 2NaOH → t → 2NaAlO 2+ Н 2O
Гидроксид алюминия – амфотерный гидроксид.
AlCl 3+ 3NH 4OH = Al(OH) 3↓ + 3NH 4Cl
AlCl 3+ 3NaOH = Al(OH) 3↓ + 3NaCl
Al(OH) 3↓ + NaOH = Na[Al(OH) 4]
Al(OH) 3↓ + 3HCl = AlCl 3+ 3H 2O
2Al(OH) 3→ t → Al 2O 3+ 3H 2O
Соли алюминия гидролизуются. Некоторые из них (Al 2S 3, Al 2(CO 3) 3) полностью разлагаются водой.
Al 2S 3+ 6Н 2O = 2Al(OH) 3↓ + 3H 2S↑
Al 2(CO 3) 3+ ЗН 2O = 2Al(OH) 3↓+ 3CO 2↑
5. IVA-группа
Элементы IVA-группы имеют электронную формулу ns 2np 2. Углерод и кремний являются неметаллами, германий, олово, свинец – металлами. Для элементов характерны степени окисления +4, +2, 0, -4 и валентность IV. В возбужденном состоянии атомы имеют конфигурацию ns 1np s, в этом состоянии для них характерна sp 3 -гибридизация.
5.1. Свойства углерода и его соединений
Характерные степени окисления углерода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
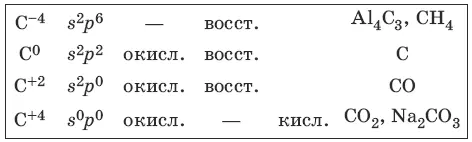
Свойства углерода
2С + O 2(недостаток) → t → 2CO
С + O 2(избыток) → t → CO 2
С + CO 2→ t → 2CO
С + CuO → t → Cu + CO
4С + Fe 3O 4→ t → 3Fe + 4CO
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





