М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
O 2+ 2F 2= OF 2
2Са + O 2= 2СаО
S + O 2= SO 2
2С 2Н 2+ 5O 2= 4CO 2+ 2Н 2O
4FeS 2+ 11O 2→ t → 2Fe 2O 3+ 8SO 2
4NH 3+ 3O 2= 6Н 2O + 2N 2
4NH 3+ 5O 2 → p, t, Pt → 4NO + 6Н 2O
Получение и свойства озона O 3
3O 2 → hv → 2O 3
O 3= O 2+ О
KI + Н 2O + O 3= I 2+ 2KOH + O 2
Свойства пероксида водорода
ВaO 2+ H 2SO 4= BaSO 4↓ + Н 2O 2(на холоду)
2Н 2O 2 → MnO 2 → 2Н 2O + O 2
2KMnO 4+ 3H 2SO 4+ 5Н 2O 2= 5O 2+ 2MnSO 4+ K 2SO 4+ 8H 2O
2KI + H 2SO 4+ H 2O 2= I 2+ K 2SO 4+ 2Н 2O
Н 2O 2+ O 3= 2O 2+ Н 2O
7.2. Сера и ее соединения
Характерные степени окисления серы, соответствующие им электронные формулы, химические свойства и примеры соединений приведены в таблице.
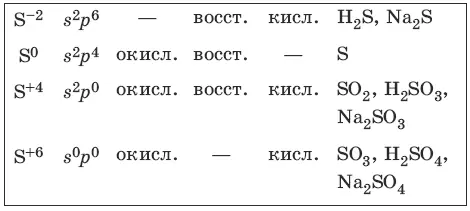
Чистая сера – хрупкое кристаллическое вещество желтого цвета. Сера имеет несколько модификаций: ромбоэдрическую и призматическую, также пластическую (аморфную). Аллотропия серы обусловлена различной структурой кристаллов, построенных из восьмиатомных молекул S 8. В расплаве серы существуют молекулы S 8, S 6, в парах серы – молекулы S 6, S 4, S 2.
Получение и свойства серы
FeS 2→ t → FeS + S
SO 2+ 2H 2S = 3S + 2H 2O
S + O 2→ t → SO 2
Fe + S → t → FeS
Hg + S = HgS
S + 6HNO 3(конц.) = H 2SO 4+ 6NO 2+ 2H 2O
Получение и свойства соединений серы (-2)
FeS + 2HCl = FeCl 2+ H 2S
H 2S ↔ H ++ HS¯ ↔ 2H ++ S 2-
2H 2S + O 2(недостаток) = 2S↓ + 2H 2O
2H 2S + 3O 2(избыток) → t → 2SO 2+ 2H 2O
2H 2S + SO 2= 3S↓ + 2H 2O
H 2S + I 2= S↓+ 2HI
5H 2S + 3H 2SO 4+ 2KMnO 4= 5S↓ + 2MnSO 4+ K 2SO 4+ 8H 2O
3H 2S + 4H 2SO 4+ K 2Cr 2O 7= 3S↓ + Cr 2(SO 4) 3+ K 2SO 4+ 7H 2O
2NaOH + H 2S = Na 2S + 2H 2O
Na 2S + 2H 2O ↔ NaHS + NaOH
Al 2S 3+ 6H 2O = 2Al(OH) 3↓ + 3H 2S↑
3Na 2S + Cr 2(SO 4) 3+ 6H 2O = 2Cr(OH) 3↑ + 3H 2S↑+ 3Na 2SO 4
Получение и свойства соединений серы (+4)
S + О 2→ t → SO 2
4FeS 2+ 11O 2→ t → 2Fe 2O 3+ 8SO 2
SO 2+ Н 2O ↔ H 2SO 3 ↔ Н ++ HSO 3¯ ↔ 2Н ++ SO 3 2-
Na 2SO 3+ 2HCl = 2NaCl + H 2O + SO 2↑
SO 2+ NaOH = NaHSO 3
SO 2+ 2NaOH = Na 2SO 3+ H 2O
H 2SO 3+ 2H 2S = 3S↓ + 3H 2O
2SO 2+ O 2 → p, t, Pt → 2SO 3
H 2SO 3+ Cl 2+ H 2O = H 2SO 4+ 2HCl
5SO 2+ 2H 2O + 2KMnO 4= 2H 2SO 4+ 2MnSO 4+ K 2SO 4
Получение и свойства соединений серы (+6)
4FeS 2+ 11O 2→ t → 2Fe 2O 3+ 8SO 2
2SO 2+ O 2 → p, t, V 2O 5 → 2SO 3
H 2O + SO 3= H 2SO 4
H 2SO 4+ SO 3= H 2SO 4 • SO 3= H 2S 2O 7(олеум)
H 2S 2O 7+ H 2O = 2H 2SO 4
Fe + H 2SO 4(разб.) = FeSO 4+ H 2
Cu + H 2SO 4(разб.) ≠
H 2SO 4(конц.) + H 2O = H 2SO 4 • H 2O + Q
Концентрированная серная кислота пассивирует на холоду Al, Fe, Cr.
2Fe + 6H 2SO 4(конц.) → t → Fe 2(SO 4) 3+ 3SO 2+ 6Н 2O
Cu + 2H 2SO 4(конц.) → t → CuSO 4+ SO 2+ 2Н 2O
3Zn + 4H 2SO 4(конц.) = 3ZnSO 4+ S + 4H 2O
4Ca + 5H 2SO 4(конц.) = 4CaSO 4+ H 2S + 4H 2O
2H 2SO 4(конц.) + S → t → 3SO 2+ H 2O
2H 2SO 4(конц.) + С → t → 2SO 2+ CO 2+ 2H 2O
8. VIIA-группa
Атомы галогенов, образующих VIIA-группу, имеют электронную конфигурацию ns 2np 5. Все галогены являются активными неметаллами, окислителями. Их активность уменьшается в ряду F > Cl > Br > I > At. Характерные степени окисления галогенов: -1, 0, +1, +3, +5, +7. Однако у фтора, наиболее активного неметалла, есть лишь степени окисления -1 и 0. F 2и Cl 2– газы, Br 2– жидкость, I 2– твердое вещество. С увеличением радиуса атомов галогенов растет объем их атомов и молекул, а также их поляризуемость. Это приводит к увеличению сил межмолекулярного взаимодействия (сил Ван дер Ваальса) и повышению температур плавления и кипения простых веществ.
HF, HCl, HBr, HI при растворении в воде образуют кислоты (HF – слабую, HCl, HBr и HI – сильные). В HF имеются сильные водородные связи. В ряду HCl – HBr – HI сила кислот несколько увеличивается в связи с увеличением поляризуемости молекул, пропорциональной их объему.
Электронная формула атома водорода 1s 1. С галогенами его объединяет способность принимать один электрон и образовывать стабильную электронную оболочку 1s 2. Поэтому часто водород располагают вместе с галогенами в VIIA-группе.
8.1. Водород и его соединения
Водород – наиболее распространенный элемент во Вселенной. Водород – легкий газ без цвета, без запаха. Возможные степени окисления водорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
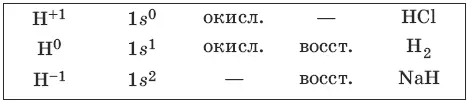
CH 4+ 2Н 2O → t, катализатор → 4Н 2+ CO 2
Zn + 2HCl = ZnCl 2+ Н 2
(NaOH) + 2Н 2O → электролиз раствора → 2Н 2+ O 2
Н 2+ 2Na → t → 2NaH
Н 2+ Са → t → СаН 2
2Н 2+ O 2= 2Н 2O
Н 2+ Cl 2→ hv → 2HCl
ЗН 2+ N 2→ t, p, катализатор → 2NH 3
NaH + Н 2O = NaOH + Н 2
СаН 2+ 2HCl = CaCl 2+ 2Н 2
8.2. Вода
Молекулы воды связаны водородными связями: n H 2O = (Н 2O) n , поэтому вода жидкая в отличии от ее газообразных аналогов H 2S, H 2Se и Н 2Те.
Кислород в молекуле воды находится в состоянии sp 3 -гибридизации, две связи О—Н и две неподеленные пары кислорода располагаются тетраэдрически, угол между связями О—Н равен 104,5°, поэтому молекула воды полярная. Вода является хорошим растворителем для веществ с ионными или полярными связями.
2Na + 2Н 2O = 2NaOH + Н 2
Fe + 4Н 2O → t → Fe 3O 4+ 4Н 2
Ag + Н 2O ≠
Н 2O + СаО = Са(OH) 2
Н 2O + Al 2O 3≠
N 2O 3+ Н 2O = 2HNO 2
2CuSO 4+ 2Н 2O ↔ (CuOH) 2SO 4+ H 2SO 4
H 2SO 4(конц.) + H 2O = H 2SO 4 • H 2O
CuSO 4+ 5H 2O = CuSO 4• 5H 2O
8.3. Фтор и его соединения
Фтор является наиболее активным неметаллом, сильным окислителем.
F 2+ Н 2= 2HF
2F 2+ 2Н 2O = 4HF + O 2
F 2+ 2NaCl = 2NaF + Cl 2
4HF + SiO 2= SiF 4↑ + 2Н 2O
8.4. Хлор и его соединения
Хлор – тяжелый газ желто-зеленого цвета, с резким запахом.
2NaCl + 2Н 2O → электролиз раствора → Н 2+ Cl 2+ 2NaOH
2KMnO 4+ 16HCl = 2KCl + 2MnCl 2 + 5Cl 2+ 8Н 2O
MnO 2+ 4HCl = Cl 2+ MnCl 2+ 2Н 2O
Cl 2+ Н 2→ hv → 2HCl
CH 4+ Cl 2→ hv → CH 3Cl + HCl
С 2Н 4+ Cl 2= С 2Н 4Cl 2
Cl 2+ 2KBr = 2KCl + Br 2
Cl 2+ Н 2O = HCl + HClO (реакция диспропорционирования)
HClO = HCl + О (атомарный кислород – окислитель)
Cl 2+ 2KOH = KCl + KClO +Н 2O
2Cl 2+ 2Са(OH) 2= CaCl 2+ Са(ClO) 2+ 2Н 2O
Смесь CaCl 2и Са(ClO) 2– хлорная, или белильная, известь.
ЗCl 2+ 6KOH → 100 °C → 5KCl + KClO 3+ ЗН 2O
KClO 3– хлорат калия, или бертолетова соль.
4KClO 3→ 400 °C → KCl + ЗKClO 4
2KClO 3→ v →2KCl + 3O 2
Сила кислот растет в ряду:
HClO → HClO 2 → HClO 3 → HClO 4.
2HCl + Fe = FeCl 2+ H 2↑
2HCl + CuO = CuCl 2+ H 2O
3HCl + Al(OH) 3= AlCl 3+ 3H 2O
HCl + AgNO 3= AgCl↓ + HNO 3
HCl + NH 3= NH 4Cl
8.5. Бром, иод и их соединения
Бром – темно-бурая жидкость с резким запахом, а иод – кристаллическое вещество темного цвета. Изменение фазового состояния галогенов обусловлено увеличением межмолекулярного – дисперсионного взаимодействия, связанного с увеличением размеров и поляризуемости молекул галогенов в ряду хлор → бром → иод.
2NaBr + Cl 2= 2NaCl + Br 2
2NaI + Cl 2= 2NaCl + I 2
2Al + ЗBr 2= 2AlBr 3
2Al + 3I 2= 2AlI 3
Br 2+ Н 2 ↔ 2HBr
I 2+ Н 2 ^ 2Ш
AgNO 3+ NaBr = AgBr↓ + NaNO 3
AgNO 3+ NaI = AgI↓+ NaNO 3
I 2+ 2Na 2S 2O 3= 2NaI + Na 2S 4O 6
10KI + 8H 2SO 4+ 2KMnO 4= 5I 2+ 2MnSO 4+ 6K 2SO 4+ 8H 2O
9. d-Элементы
В атомах d-элементов (переходных элементов) заполняется электронами d-под-уровень предвнешнего уровня. На внешнем уровне атомы d -элеметов имеют, как правило, два s-электрона. Близость строения валентных уровней атомов переходных элементов определяет их общие свойства. Все они являются металлами, имеют высокую прочность, твердость, высокую электро– и теплопроводность. Многие из них электроположительны и растворяются в минеральных кислотах, однако среди них есть металлы, не взаимодействующие обычным способом с кислотами. Большинство переходных металлов имеют переменную валентность. Максимальная валентность, как и максимальная степень окисления, как правило, равно номеру группы, в которой находится данный элемент.
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





