М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
Предельная концентрация (c lim) – наименьшая концентрация определяемого вещества, при которой оно может быть обнаружено в растворе данной реакцией по данной методике. Выражается в г/мл.
Предельное разбавление (V lim) – объем раствора с предельной концентрацией, в котором содержится 1 г определяемого вещества. Предельное разбавление выражается в мл/г.
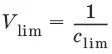
Минимальный объем предельно разбавленного раствора (V min) – наименьший объем (мл) раствора определяемого вещества, необходимый для его обнаружения данной реакцией.
m = C lim• V min• 10 6,
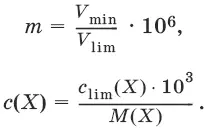
сильных кислот: рН = – lg a (H +) = – lg ( c (H +) / f (Н +))
сильных оснований: рН = 14 + lg a (OH¯) = 14 + lg ( c (OH¯) f (OH¯))
слабых кислот: рН = – ½(р K кислоты– lg c ) = – ½K кислоты – ½ lg c
слабых оснований: рН = 14 – ½р K основания+ ½lg c
солей, образованных сильным основанием и слабой кислотой: рН = 7 + ½p K кислоты+ ½lg c соли
солей, образованных слабым основанием и сильной кислотой: рН = 7 – ½ K основания– lg c соли
солей, образованных слабым основанием и слабой кислотой: рН = 7 + ½p K кислоты+ ½p K основания
кислого буферного раствора:

щелочного буферного раствора:
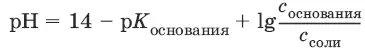
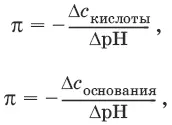
Вычисление буферной емкости.Емкость буферного раствора определяется количеством сильной кислоты или сильного основания, которое необходимо добавить к 1 л буферного раствора, чтобы изменить его значение рН на единицу.

Гетерогенное равновесие: осадок – насыщенный раствор малорастворимого соединения.Гетерогенное равновесие между осадком малорастворимого соединения и его ионами в насыщенном водном растворе может быть представлено следующим уравнением:
Kt m An n ↓ ↔ mKt n ++ n An m -
[Kt n +] = m s ; [An m -] = n • s
Константа равновесия обратимой реакции осаждения-растворения называется произведением растворимости K s (или ПР) и выражается следующим образом:
K s= a (Kt n +) m a (An m -) n = ( f (Kt n +) x [Kt n +]) m • ( f (An m- )[An m -]) n = ( ms) m(ns) n• f (Kt n +) m • f (An n -) n = n nm ms m+n • f (Kt n +) m • f (An m -) n , или K s= n n• m m• s m + n
Растворимость – это свойство вещества образовывать гомогенные системы с растворителем. Молярная растворимость малорастворимого вещества (s), моль/л, выражается следующим образом:

Зная молярную растворимость соединения Kt m An n , легко вычислить его растворимость в г/л ρ по формуле:
ρ = s • M(Kt m An n )
Массу малорастворимого вещества в любом объеме можно рассчитать по формуле:
m (Kt m An n ) = s(Kt m An n ) • M(Kt m An n ) x V р-ра
Условие образования и растворения осадка.Осадок не образуется или растворяется, если произведение концентраций ионов осадка в растворе меньше величины произведения растворимости.
[Kt n +] m [An m -] n < K s (Kt m An n )
Осадок образуется или выпадает, если произведение концентраций ионов осадка в растворе больше величины произведения растворимости.
[Kt n +] m [An m -] n > K s (Kt m An n ).
Равновесия в окислительно-восстановительных системах.Для обратимой окислительно-восстановительной реакции
Oх + nē ↔ Red
Равновесный потенциал E ox/ redсо стандартным потенциалом редокс-пары E ox/ redи активностью окисленной и восстановленной формы связан уравнением Нернста:
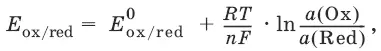
где R – универсальная газовая постоянная, равная 8,314 Дж/моль К, Т – температура по шкале Кельвина, К, T – число Фарадея, равное 96485 Кл/моль, а (Ох) – активность окисленной формы, a (Red) – активность восстановленной формы.
При подстановке в уравнение значений универсальной газовой постоянной, числа Фарадея, температуры Т = 298 К и замены натурального логарифма на десятичный получается уравнение для расчета значения равновесного электродного потенциала редокс-пары при 25°C:
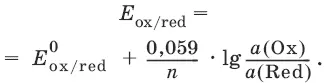
Если в окислительно-восстановительных реакциях принимают участие ионы водорода, то уравнение Нернста выглядит следующим образом:

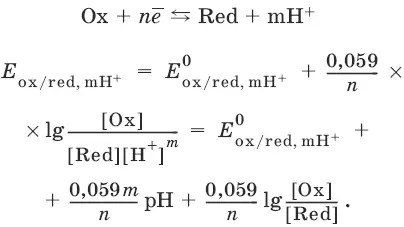
Если окисленная или восстановленная форма окислительно-восстановительной полуреакции является малорастворимым соединением, то в формулу для вычисления равновесного потенциала такой системы входит величина произведения растворимости этого соединения.
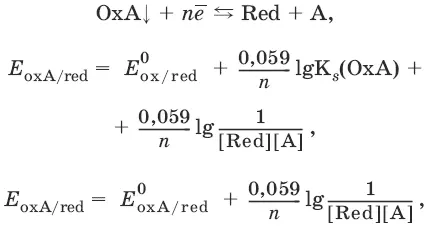
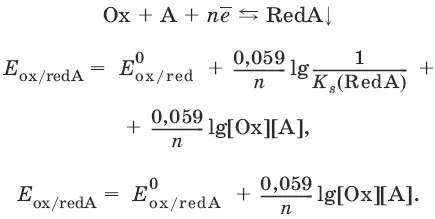
Если в окислительно-восстановительной полуреакции окисленной формой является комплексное соединение OxL m , характеризующееся константой устойчивости β(OxL m ), то равновесный окислительно-восстановительный потенциал вычисляется по уравнению:
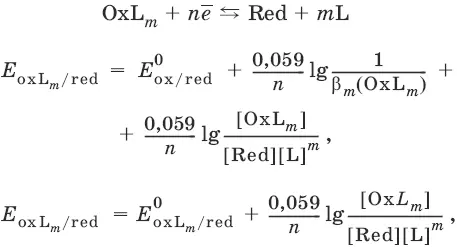
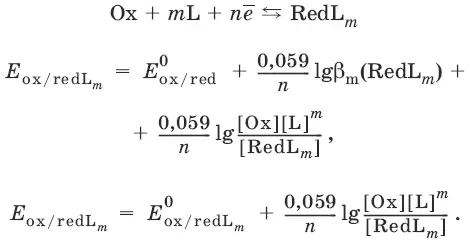
Направление и глубина протекания окислительно-восстановительных реакций.Обратимая окислительно-восстановительная реакция
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





