М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
7. 2 н- С 4Н 10+ 5O 2 → 4CH 3COOH + 2Н 2O (окисление алканов в промышленности; получение уксусной кислоты)
8. н- С 4Н 10 → изо- С 4Н 10(изомеризация, катализатор AlCl 3)
2. Циклоалканы
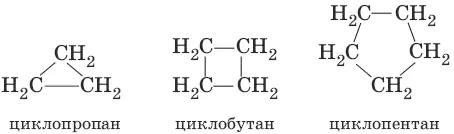
Циклоалканы (циклопарафины, нафтены, цикланы, полиметилены) – предельные углеводороды с замкнутой (циклической) углеродной цепью. Общая формула С n H 2n.
Атомы углерода в циклоалканах, как и в алканах, находятся в sp 3 -гибридизованном состоянии. Гомологический ряд циклоалканов начинает простейший циклоалкан – циклопропан С 3Н 6, представляющий собой плоский трехчленный карбоцикл. По правилам международной номенклатуры в циклоалканах главной считается цепь углеродных атомов, образующих цикл. Название строится по названию этой замкнутой цепи с добавлением приставки «цикло» (циклопропан, циклобутан, циклопентан, циклогексан и т. д.).
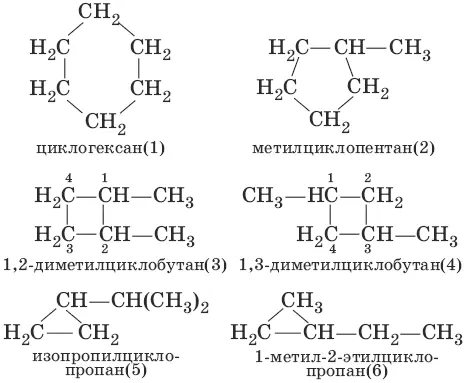
Структурная изомерия циклоалканов связана с различной величиной цикла (структуры 1 и 2), строением и видом заместителей (структуры 5 и 6) и их взаимным расположением (структуры 3 и 4).
1. Получение из дигалогенопроизводных углеводородов
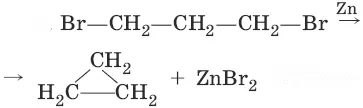
2. Получение из ароматичесих углеводородов
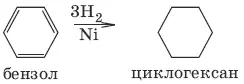
Химические свойства циклоалканов зависят от размера цикла, определяющего его устойчивость. Трех– и четырехчленные циклы (малые циклы), являясь насыщенными, резко отличаются от всех остальных предельных углеводородов. Циклопропан, циклобутан вступают в реакции присоединения. Для циклоалканов (С 5и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т. е. реакции замещения.
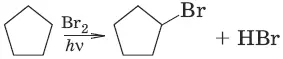
1. Действие галогенов
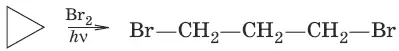

2. Действие галогеноводородов
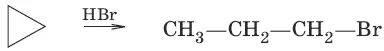
С циклоалканами, содержащими пять и более атомов углерода в цикле, галогеново-дороды не взаимодействуют.
3.
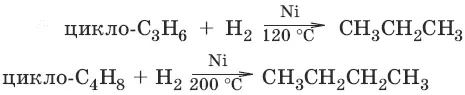
4. Дегидрирование
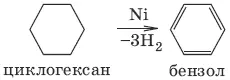
3. Алкены
Алкены (непредельные углеводороды, этиленовые углеводороды, олефины) – непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула ряда алкенов С nН 2n.
По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса – анна – ен: этан (CH 3—CH 3) – этен (CH 2=CH 2) и т. д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь. Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи.
В молекуле алкена ненасыщенные атомы углерода находятся в sp 2 -гибридизации, а двойная связь между ними образована σ– и π-связью. sp 2 -Гибридные орбитали направлены друг к другу под углом 120°, и одна негибридизованная 2р -орбиталь, расположена под углом 90° к плоскости гибридных атомных орбиталей.
Пространственное строение этилена:
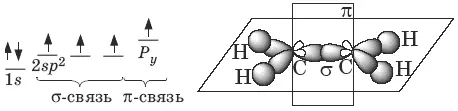
Длина связи С=С 0,134 нм, энергия связи С=С Е с=с = 611 кДж/моль, энергия π-связи Еπ = 260 кДж/моль.
Виды изомерии: а) изомерия цепи; б) изомерия положения двойной связи; в) Z, Е (cis, trans ) – изомерия, вид пространственной изомерии.
1. CH 3—CH 3 → Ni, t → CH 2=CH 2+ H 2(дегидрирование алканов)
2. С 2Н 5OH →H,SO 4, 170 °C→ CH 2=CH 2+ Н 2O (дегидратация спиртов)
3. (дегидрогалогенирование алкилгалогенидов по правилу Зайцева)
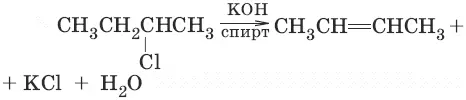
4. CH 2Cl—CH 2Cl + Zn → ZnCl 2+ CH 2=CH 2(дегалогенирование дигалогенопроизводных)
5. HC≡CH + Н 2 → Ni, t → CH 2=CH 2(восстановление алкинов)
Для алкенов наиболее характерны реакции присоединения, они легко окисляются и полимеризуются.
1. CH 2=CH 2+ Br 2 → CH 2Br—CH 2Br
(присоединение галогенов, качественная реакция)
2. (присоединение галогеноводородов по правилу Марковникова)
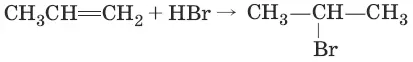
3. CH 2=CH 2+ Н 2 → Ni, t → CH 3—CH 3(гидрирование)
4. CH 2=CH 2+ Н 2O → H + → CH 3CH 2OH (гидратация)
5. ЗCH 2=CH 2+ 2КMnO 4+ 4Н 2O → ЗCH 2OH—CH 2OH + 2MnO 2↓ + 2KOH (мягкое окисление, качественная реакция)
6. CH 2=CH—CH 2—CH 3+ КMnO 4→ H + → CO 2+ С 2Н 5COOH (жесткое окисление)
7. CH 2=CH—CH 2—CH 3+ O 3 → Н 2С=O + CH 3CH 2CH=O формальдегид+пропаналь → (озонолиз)
8. С 2Н 4+ 3O 2 → 2CO 2+ 2Н 2O (реакция горения)
9. (полимеризация)
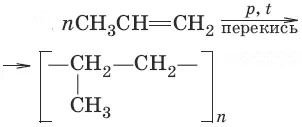
10. CH 3—CH=CH 2+ HBr → перекись → CH 3—CH 2—CH 2Br (присоединение бро-моводорода против правила Марковникова)
11. (реакция замещения в α-положение)
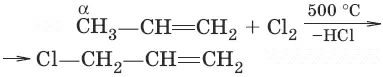
4. Алкины
Алкины (ацетиленовые углеводороды) – ненасыщенные углеводороды, имеющие в своем составе тройную С≡С связь. Общая формула алкинов с одной тройной связью С nН 2n-2. Простейший представитель ряда алкинов CH≡CH имеет тривиальное название ацетилен. По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса – анна -ин: этан (CH 3—CH 3) – этин (CH≡CH) и т. д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь. Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи.
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





