М. Рябов - Сборник основных формул по химии для ВУЗов
- Название:Сборник основных формул по химии для ВУЗов
- Автор:
- Жанр:
- Издательство:АСТ: Астрель
- Год:2007
- Город:Москва
- ISBN:5-17-041782-9, 5-271-15880-2
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
М. Рябов - Сборник основных формул по химии для ВУЗов краткое содержание
В пособии приведены все основные формулы, уравнения реакций, а также даны определения по общей, неорганической, аналитической, органической и физической химии.
Предназначено для студентов нехимических специальностей вузов, а также может быть полезно абитуриентам.
Сборник основных формул по химии для ВУЗов - читать онлайн бесплатно ознакомительный отрывок
Интервал:
Закладка:
В образовании тройной связи участвуют атомы углерода в sp -гибридизованном состоянии. Каждый из них имеет по две sp- гибридных орбитали, направленных друг к другу под углом 180°, и две негибридных p -орбитали, расположенных под углом 90° по отношению друг к другу и к sp -гибридным орбиталям.
Пространственное строение ацетилена:
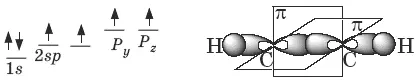
Виды изомерии: 1) изомерия положения тройной связи; 2) изомерия углеродного скелета; 3) межклассовая изомерия с алкадиенами и циклоалкенами.
1.СаО + ЗС → t → СаС 2+ CO;
СаС 2+ 2Н 2O → Са(OH) 2+ CH≡CH (получение ацетилена)
2. 2CH 4 → t>1500 °C → HC = CH + ЗН 2(крекинг углеводородов)
3. CH 3—CHCl 2+ 2KOH → в спирте → HC≡CH + 2KCl + Н 2O (дегалогенирова-ние)
CH 2Cl—CH 2Cl + 2KOH → в спирте → HC≡CH + 2KCl + Н 2O
Для алкинов характерны реакции присоединения, замещения. Алкины полиме-ризуются, изомеризуются, вступают в реакции конденсации.
1. (гидрирование)
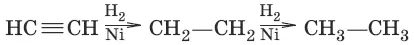
2. HC≡CH + Br 2 → CHBr=CHBr;
CHBr=CHBr + Br 2 → CHBr 2—CHBr 2(присоединение галогенов, качественная реакция)
3. CH 3—С≡CH + HBr → CH 3—CBr=CH 2;
CH 3—CBr=CH 2 + HBr → CH 3—CBr 2—CHg (присоединение галогеноводородов по правилу Марковникова)
4. (гидратация алинов, реация Кучерова)
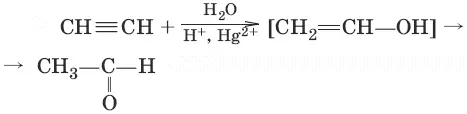
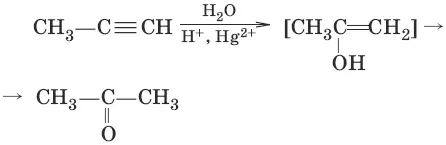
5.(присоединение спиртов)
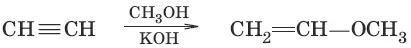
6.(присоединение карбоновых ислот)
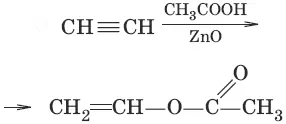
7. CH≡CH + 2Ag 2O → NH 3 → AgC≡CAg↓ + H 2O (образование ацетиленидов, качественная реакция на концевую тройную связь)
8. CH≡CH + [О] → КMnO 4 → HOOC—COOH → HCOOH + CO 2(окисление)
9. CH≡CH + CH≡CH → CH 2=CH—С≡CH (катализатор – CuCl и NH 4Cl, димеризация)
10. 3HC≡CH → C, 600 °C → С 6Н 6(бензол) (циклоолигомеризация, реакция Зелинского)
5. Диеновые углеводороды
Алкадиены (диены) – непредельные углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов С nН 2n_ 2. Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах.
1. (метод СВ. Лебедева)
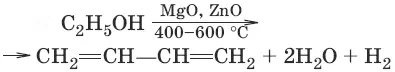
2. (дегидратация)
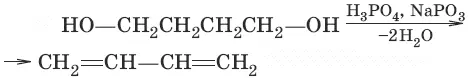
3. (дегидрирование)
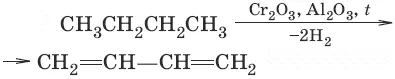
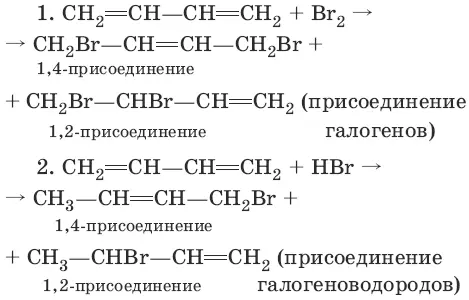
Для сопряженных диенов характерны реакции присоединения. Сопряженные диены способны присоединять не только по двойным связям (к C 1и С 2, С 3и С 4), но и к концевым (С 1и С 4) атомам углерода с образованием двойной связи между С 2и С 3.
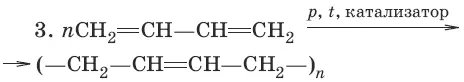
6. Ароматические углеводороды
Арены, или ароматические углеводороды, – циклические соединения, молекулы которых содержат устойчивые циклические группы атомов с замкнутой системой сопряженных связей, объединяемые понятием ароматичности, которая обуславливает общие признаки в строении и химических свойствах.
Все связи С—С в бензоле равноценны, их длина равна 0,140 нм. Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф. Кекуле), а все они выровнены (дел окал изованы).
Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R): С 6Н 5—R, R—С 6Н 4—R. Общая формула гомологического ряда бензола С nН 2n_ 6 (n > 6). Для названия ароматических углеводородов широко используются тривиальные названия (толуол, ксилол, кумол и т. п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова «бензол» (корень): С 6Н 5—CH 3(метилбензол), С 6Н 5—С 2Н 5(этилбензол). Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Для дизамещен-ных бензолов R—С 6Н 4—R используется также и другой способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками: орто– ( o -) – заместители соседних атомов углерода кольца (1,2-); мета– ( м -) – заместители через один атом углерода (1,3-); пара– ( п -) – заместители на противоположных сторонах кольца (1,4-).
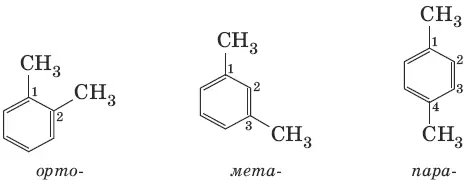
Виды изомерии (структурная): 1) положения заместителей для ди-, три– и тетра-замещенных бензолов (например, о-, м- и п -ксилолы); 2) углеродного скелета в боковой цепи, содержащей не менее 3 атомов углерода; 3) заместителей (R), начиная с R=С 2Н 5.
1. С 6Н 12 → Pt, 300 °C → С 6Н 6+ ЗН 2(дегидрирование циклоалканов)
2. н- С 6Н 14→ Cr 2O 3, 300 °C → С 6Н 6+ 4Н 2(дегидроциклизация алканов)
3. ЗС 2Н 2→ С, 600 °C → С 6Н 6(циклотримеризация ацетилена, реакция Зелинского)
По химическим свойствам арены отличаются от предельных и непредельных углеводородов. Для аренов наиболее характерны реакции, идущие с сохранением ароматической системы, а именно реакции замещения атомов водорода, связанных с циклом. Другие реакции (присоединение, окисление), в которых участвуют делокали-зованные С-С связи бензольного кольца и нарушается его ароматичность, идут с трудом.
1. C 6H 6+ Cl 2→ AlCl 3 → C 6H 5Cl + HCl (галогенирование)
2. C 6H 6+ HNO 3→ H 2SO 4 → C 6H 5—NO 2+ H 2O (нитрование)
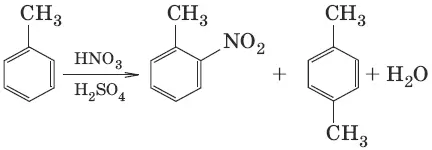
3. С 6Н 6→ H 2SO 4 → С 6Н 5—SO 3H + H 2O (сульфирование)
Читать дальшеИнтервал:
Закладка:




![Кирилл Рябов - Никто не вернётся [сборник litres]](/books/1057252/kirill-ryabov-nikto-ne-vernetsya-sbornik-litres.webp)





