Нина Веселовская - Наркотики
- Название:Наркотики
- Автор:
- Жанр:
- Издательство:Триада-Х
- Год:2000
- Город:Москва
- ISBN:нет данных
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Нина Веселовская - Наркотики краткое содержание
Наркотики - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Дальнейшее изучение показало, что реализация того или иного механизма обезболивания осуществляется разными оптическими изомерами. Это же объясняет кажущееся несоответствие низкого уровня свойственных опиоидам побочных эффектов (угнетение жизненноважных функций, развитие лекарственной зависимости) эффективности анальгетического действия ТРМ. Данные, полученные в экспериментах in vitro и in vivo, показали, что (+) – и (–)–энантиомеры ТРМ имеют различный фармакологический профиль и по разному реализуют анальгетический эффект. (+)–Энантиомер активнее примерно в 10 раз и обладает большим сродством к опиоидным мю–рецепторам, в то время как (–)–энантиомер в основном действует как неопиоидный анальгетик. Синергизм действия энантиомеров, установленный в отношении анальгетической активности, в отношении побочных эффектов не проявляется, в результате чего обезболивающий эффект рацемического ТРМ выше, чем каждого энантиомера, а уровень побочных эффектов ниже.
Фармакокинетика трамадола
Аналгезирующее действие при оральном приеме терапевтической дозы 50–150 мг ТРМ наступает через 30–60 мин, при внутривенном введении через 15–30 мин и сохраняется в течение 5–6 ч. Диапазон концентрации ТРМ в плазме составляет при этом от 10 до 1500 нг/мл. Максимальная суточная доза 400 мг. Биодоступность – 68%.
Таблица 1. Средняя концентрация трамадола в плазме, мкг/л.
| Время, час | Разовая доза 100 мг орально (А) | Повторная доза 4 р 100 мг в день орально (Б) |
|---|---|---|
| 10 мин | 15 | 320 |
| 20 мин | 160 | 430 |
| 30 мин | 240 | 475 |
| 1 | 255 | 490 |
| 1,5 | 260 | 490 |
| 2 | 265 | 500 |
| 3 | 235 | 490 |
| 4 | 215 | 480 |
| 6 | 150 | 365 |
| 8 | 120 | 300 |
| 12 | 70 | 200 |
| 24 | 15 | 75 |
| 30 | 5 | 35 |
| 36 | 2 | 25 |
| 48 | 0,5 | 5 |
Таблица 2. Концентрация трамадола в плазме после внутривенного введения, нг/мл.
| Время, мин/час | А, доза 32,8 мг | В, доза 100 мг |
|---|---|---|
| 1 мин | – | 1149 |
| 3 мин | 2075 | 1011 |
| 5 мин | 484 | 941 |
| 10 мин | 236 | 635 |
| 15 мин | 173 | 582 |
| 30 мин | 138 | 579 |
| 1 час | 101 | 490 |
| 1,5 час | 89,9 | 447 |
| 2 час | 84,2 | 394 |
| 4 час | 61 | 284 |
| 8 час | 45 | 185 |
| 12 час | 34 | 122 |
| 24 час | не детектируется | 41 |
Пик концентрации в плазме после орального приема 100 мг ТРМ составляет 260–410 нг/мл и достигается по данным разных авторов, в интервале 30–60 мин, 1,6–2 или 3–4 ч. Через 12 ч концентрация уменьшается до 50–80 нг/мл и через 24 часа составляет 10–15 нг/мл. При повторных приемах ТРМ наблюдается аккумулирование самого ТРМ и метаболитов в плазме. Пик концентрации ТРМ в плазме в случае приема по 100 мг 4 раза в день составляет около 500 мкг/л, в то время как при разовом приеме 100 мг пик концентрации ТРМ около 250 мкг/л (табл. 1).
Кинетика выведения описывается двухкамерной моделью с временем «полужизни» в плазме T ½= 5,1 ч для самого ТРМ и около 9 ч для активного метаболита (O–деметилированного ТРМ).
Измерение убыли ТРМ в плазме двух добровольцев (см. табл.2) после внутривенного введения разовой дозы 32,8 и 100 мг в интервале от 1 мин до 30 ч показало наличие двух фаз распределения ТРМ. Первая в интервале от 1 до 30 мин характеризуется временем «полужизни» T ½около 30 мин и соответствует резкому снижению содержания ТРМ в системе крови. Для второй, более длительной фазы, с медленной убылью концентрации ТРМ – T ½около 6 ч. Концентрация ТРМ в плазме (доза 100 мг, внутривенно) достигает максимального значения 1149 нг/мл через 1 мин и уменьшается до 41 нг/мл через 24 ч.
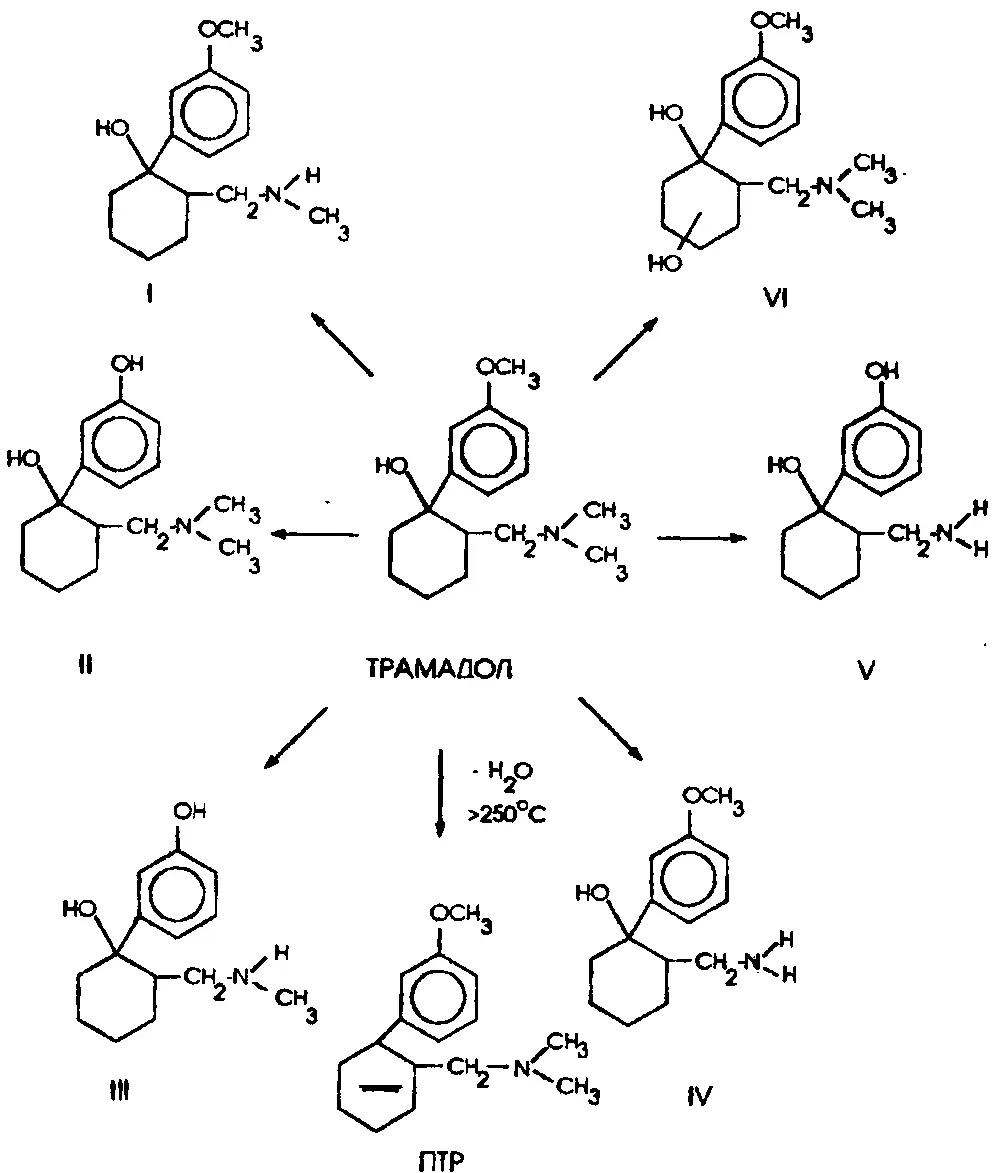
Рис. 2. Схема биотрансформации трамадола:
I – 1–(3–метоксифенил)–2–(метиламинометил)–циклогексан–1–ол (N–МТБ).
II – 1–(3–гидроксифенил)–2–(диметиламинометил)–циклогексан–1–ол (O–МТБХ).
III – 1–(3–гидроксифенил)–2–(метиламинометил)–циклогексан–1–ол (N,O–МТБ).
IV – 1–(3–метоксифенил )–2–(аминометил)–циклогексан–1–ол (N,N–МТБ).
V–1–(3–гидроксифенил)–2–(аминометил)–циклогексан–1–ол (N,N,O–МТБ).
VI – 1–(3–метоксифенил)–2–(диметиламииометил)–гидроксициклогексан–1–ол (ОН–ТРМ).
ПТР – продукт термического разложения трамадола: ангидротрамадол.
Метаболизм трамадола
ТРМ интенсивно метаболизируется в организме и образует несколько метаболитов в результате последовательного отщепления метильной группы от атомов О и N и присоединения гидроксильного радикала к циклогексановому фрагменту (рис.2).
Основные метаболиты:
■ 1–(3–гидроксифенил)–2–(диметиламинометил)–циклогексан–1–ол (O–МТБ).
■ 1–(3–метоксифенил)–2–(метиламинометил)–циклогексан–1–ол (N–МТБ).
■ 1–(3–гидроксифенил)–2–(метиламинометил)–циклогексан–1–ол (N.O–МТБ).
в меньшем количестве образуются:
■ 1–(3–метоксифенил)–2–(аминометил)–циклогексан–1–ол (N.N–МТБ).
■ 1–(3–гидроксифенил)–2–(аминометил)–циклогексан–1–ол (N,N,0–МТБ).
■ 1–(3–метоксифенил)–2–(диметиламинометил)–гидроксициклогексан–1–ол (ОН–ТРМ).
Метаболиты, содержащие гидроксильную группу, далее конъюгируются (вторая фаза метаболизма).
Кроме указанных, обнаружен метаболит, имеющий, по–видимому, структуру эпоксида циклогексанового фрагмента молекулы ТРМ. Это соединение в небольших количествах также может присутствовать в стандартных растворах ТРМ.
Наиболее важным является продукт O–деметилирования ТРМ – метаболит O–ТРМ. Он активен фармакологически, отличается большим сродством к опиатным рецепторам, чем сам ТРМ, и превышает его по анальгетической активности в 2–4 раза, подобно тому, как продукт O–деметилирования кодеина, метаболит, морфин, также превышает родительское соединение по активности.
Для метаболитических процессов характерна стереоселективность , что было доказано при изучении раздельного метаболизма рацемического ТРМ и его энантиомеров in vitro с использованием микросомальной фракции печени человека. Установлено, что деметилирование метокси– и аминогрупп молекулы ТРМ (O–деметилирование и N–деметилирование) осуществляется по разным механизмам и описывается различными фармакокинетическими моделями. O–деметилирование (+)– и (–)–ТРМ микросомами печени человека описывается однокамерной моделью, причем скорость реакции образования O–МТБ из (–)–энантиомера ТРМ выше в 2 раза, чем из (+)–энантиомера. N–МТБ предпочтительнее образуется из (+)–ТРМ и процесс описывается двухкамерной моделью. На основании изучения влияния специфических ингибиторов цитохрома (хинидина и пропафенона) сделан вывод об ответственности цитохрома Р–450IID6 за процесс O–деметилирования. Предполагается, что полиморфизм Р–450 может быть причиной индивидуальных различий в скорости образования более сильного, чем ТРМ, анальгетика: О–деметилированного метаболита, аналогично влиянию полиморфизма Р–450 на деметилирование кодеина с образованием более сильного анальгетика морфина.
Читать дальшеИнтервал:
Закладка:










