Чарльз Эллис - Эпигенетика
- Название:Эпигенетика
- Автор:
- Жанр:
- Издательство:Техносфера
- Год:2010
- Город:Москва
- ISBN:978-5-94836-257-1
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Чарльз Эллис - Эпигенетика краткое содержание
Книга ярко и наглядно повествует о новой науке общебиологического значения — эпигенетике, а также об ее отдельных областях. В издании представлено описание разных эпигенетических сигналов и механизмов их реализации, а также собственно феномен, история и концепции эпигенетики, ее отдельные механизмы и пути реализации эпигенетических сигналов в клетке. Авторы различных глав данной книги — ведущие в мире специалисты в области эпигенетики, являющиеся, как правило, и основоположниками ее отдельных областей.
Издание будет полезно широкому кругу читателей, интересующихся коренными проблемами живого мира, сущности жизни и молекулярных механизмов ее проявления.
По формирующейся традиции современной российской научной литературы, оригинальное русскоязычное печатное издание неопрятно переведено, отвратительно вычитано и содержит большое количество ошибок, начиная с обложки. Чарльз Дэвид Эллис указан как С. Д. Эллис.
Эпигенетика - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Xu G.L., Bestor T.H., Bourc’his D., Hsieh C.L., Tommerup N, Bugge M.. Hulten M.. QuX., Russo J.J.. and Viegas-Pequignot E., 1999. Chromosome instability and immunodeficiency syndrome caused by mutations in a DNA methyltransferase gene. Nature 402: 187-191.
Yntema H.G., Poppelaars F.A., Derksen E., Oudakker A.R., van Roos-malen T, Jacobs A., Obbema H., Brunner H.G., Hamel B.C., and van Bokhoven H., 2002. Expanding phenotype of XNP mutations: Mild to moderate mental retardation. Am. J. Med. Genet. 110: 243-247.
Young J.I.. Hong E.P., Castle J., Crespo-Barreto J.. Bowman A.B., Rose M.F., Kang D., Richman R., Johnson J.M., Berget S., and Zoghbi H.Y., 2005. Inaugural article: Regulation of RNA splicing by the methylation-dependent transcriptional repressor methyl-CpG binding protein 2. Proc. Natl. Acad. Sci. 102: 17551-17558.
Zeev B.B., Yaron Y, Schanen N.C., Wolf H., Brandt N., Ginot N., Shomrat R., and Orr-Urtreger A., 2002. Rett syndrome: Clinical manifestations in males with MECP2 mutations. J. Child Neurol. 17: 20-24.
Глава 24. Эпигенетические детерминанты при раковых заболеваниях

Stephen В. Baylin 1 и Peter A. Jones 2
1Cancer Biology Program, The Sidney Kimmel Cancer Center ; Johns Hopkins Medical Institutions, Baltimore, Maryland 21231
2Department of Urology Biochemistry and Molecular Biology, USC/Norris Comprehensive Cancer Center, Keck School of Medicine, University of Southern California, Los Angeles, California 90089-9181
Общее резюме
Рак вызывается наследуемым нарушением регуляции генов, которые определяют, когда клетки делятся, погибают и перемещаются из одной части тела в другую. В процессае канцерогенеза гены могут становиться активированными таким образом, что усиливают пролиферацию клеток или предотвращают клеточную гибель, или, наоборот, гены могут инактивироваться так, что они не могут более сдерживать эти процессы. Первый класс генов называется «онкогены», а второй — гены-суппрессоры опухолей («tumor suppressor genes»). Между этими двумя классами генов существует взаимодействие, которое и приводит к образованию раковой опухоли.
Гены могут инактивироваться как минимум тремя способами, включающими в себя (1) возможную мутацию гена, делающую его неспособным выполнять свою функцию, (2) полную утрату гена, что, таким образом приводит к неспособности его нормально работать и (3) ген. который не мутировал и не был утрачен, может быть наследственно выключен вследствие эпигенетических изменений. Такой эпигенетический сайленсинг может включать в себя модификации гистонов, связывание белков-репрессоров и неправильное метилирование остатков цитозина (С) в СрС-мотивах, которые находятся внутри контрольных участков, управляющих экспрессией генов.
В данной главе делается акцент на на этом третьем пути. Основные молекулярные механизмы, отвечающие за поддержание «молчащего» состояния, довольно хорошо понятны, что и представлено в этой книге. Далее, мы также знаем, что эпигенетический сайленсинг имеет важное значение для профилактики, диагностики и терапии раковых заболеваний. В нашем распоряжении сейчас имеются лекарства, одобренные американской FDA, которые могут ревертировать эпигенетические изменения и восстановить генную активность в раковых клетках. Поскольку изменения в метилировании ДНК можно анализировать с высокой степенью чувствительности, многие стратегии в ранней диагностике раковых заболеваний базируются на выявлении изменений в метилировании ДНК. Поэтому возможности эпигенетики в исследованиях, диагностике, профилактике и лечении рака у человека, являются совершенно исключительными.
1. Биологическая основа раковых заболеваний
В конечном счете, рак является заболеванием экспрессии генов, при котором нарушается нормальная работа сложных сетей, управляющих гомеостазом у многоклеточных организмов, что позволяет клеткам расти вне связи с нуждами организма как целого. Большие успехи были достигнуты в описании той подгруппы клеточных контрольных путей, которые нарушаются при раке у человека (табл. 24.1). Тот факт, что почти при всех раковых заболеваниях, наследуемым нарушениям подвержено это ограниченное число клеточных контрольных путей, и является ключевой идеей, которая продвинула данную область исследований (Hanahan and Weinberg, 2000). Основное внимание до последних нескольких лет было сосредоточено на генетических основах раковых заболеваний, в частности, на мутационной активации онкогенов или инактивации генов-супрессоров опухолей. Однако увеличивающийся массив данных, появившихся с середины 1990-х годов, показывает, что наследуемые изменения, регулируемые эпигенетическими модификациями, также могут играть критическую роль в эволюции раковых заболеваний всех типов у человека (рис. 24.1) (Jones and Laird, 1999; Jones and Baylin, 2002; Herman and Baylin, 2003). Эти данные, в частности паттерны метилирования ДНК и хроматина, которые при раке фундаментально изменяются, привели к новым возможностям в понимании, диагностике, лечении и профилактике раковых заболеваний.
Генетические и эпигенетические аномалии могут вызывать наследуемые нарушения путей обеспечения гомеостаза при помощи двух различных механизмов. Может иметь место либо активация онкогенов, в основном, через активацию точечных мутаций, либо могут быть инактивированы гены-супрессоры опухолей (Jones and Laird, 1999; Hanahan and Weinberg, 2000; Jones and Baylin, 2002; Herman and Baylin, 2003). Например, при раковых заболеваниях человека часто обнаруживаются мутации в сигнальном гене (онкогене), таком как RAS , которые усиливают активность генного продукта в стимуляции роста. Эти мутации часто являются доминантными и стимулируют возникновение онкологических заболеваний. С другой стороны, генетические мутации и эпигенетический сайленсинг генов-супрессоров опухолей, часто являются рецессивными, требующими разрушительных событий в обеих аллельных копиях гена для полной экспрессии трансформированного фенотипа. Идея о том, что в малигнизированной клеточной линии должны быть выведены из строя обе копии гена-супрессора опухолей была предложена Кнудсоном (Knudson, 2001) и широко принята. Сейчас понятно, что три класса «ударов» могут действовать в различных комбинациях, вызывая полную потерю активности генов-супрессоров опухолей Прямые мутации в кодирующей последовательности, потеря частей или целых копий генов, или эпигенетический сайленсинг могут взаимодействовать друг с другом, что может приводить ключевые контрольные гены в нерабочее состояние (рис. 24.2).
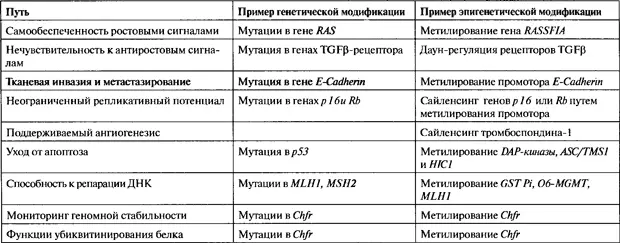
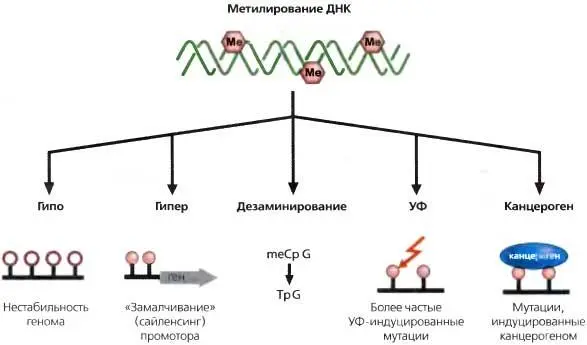
Рис. 24.1.Эпигенетические изменения, связанные с метилированием ДНК, могут приводить к раковым заболеваниям при помощи различных механизмов
Читать дальшеИнтервал:
Закладка: