Чарльз Эллис - Эпигенетика
- Название:Эпигенетика
- Автор:
- Жанр:
- Издательство:Техносфера
- Год:2010
- Город:Москва
- ISBN:978-5-94836-257-1
- Рейтинг:
- Избранное:Добавить в избранное
-
Отзывы:
-
Ваша оценка:
Чарльз Эллис - Эпигенетика краткое содержание
Книга ярко и наглядно повествует о новой науке общебиологического значения — эпигенетике, а также об ее отдельных областях. В издании представлено описание разных эпигенетических сигналов и механизмов их реализации, а также собственно феномен, история и концепции эпигенетики, ее отдельные механизмы и пути реализации эпигенетических сигналов в клетке. Авторы различных глав данной книги — ведущие в мире специалисты в области эпигенетики, являющиеся, как правило, и основоположниками ее отдельных областей.
Издание будет полезно широкому кругу читателей, интересующихся коренными проблемами живого мира, сущности жизни и молекулярных механизмов ее проявления.
По формирующейся традиции современной российской научной литературы, оригинальное русскоязычное печатное издание неопрятно переведено, отвратительно вычитано и содержит большое количество ошибок, начиная с обложки. Чарльз Дэвид Эллис указан как С. Д. Эллис.
Эпигенетика - читать онлайн бесплатно полную версию (весь текст целиком)
Интервал:
Закладка:
Утрата метилирования по цитозину в ДНК (гипо) приводит к нестабильности генома. Локальное гиперметилирование в промоторе гена (гипер) вызывает наследуемый сайленсинг и, следовательно, инактивацию генов-супрессоров опухоли. Кроме того, метилированные сайты CpG представляют собой горячие точки для мутаций типа транзиций С>Т, вызванных спонтанным гидролитическим дезаминированием. Метилирование сайтов CpG также повышает связывание некоторых химических канцерогенов с ДНК и повышает частоту мутаций, индуцированных УФ-излучением
2. Значение хроматина для раковых заболеваний
Несмотря на важнейшие достижения в понимании ключевых молекулярных повреждений путей клеточного контроля, способствующих возникновению раковых заболеваний, остается истиной то, что микроскопическое исследование цитологом-патологом структуры ядра по-прежнему является золотым стандартом в диагностике раковых заболеваний. Человеческий глаз может точно разглядеть изменения в архитектонике ядра, которая, в основном, отражает состояние конфигурации хроматина, и определенно диагносцировать раковый фенотип в одиночной клетке. В качестве признаков патологи в первую очередь используют величину ядра, его очертания, конденсированную ядерную мембрану, отчетливые ядрышки, плотный «гиперхроматиновый» хроматин и высокие значения ядерно-плазменного отношения. Эти структурные характеристики, которые видны под микроскопом (рис. 24.3), по-видимому, коррелируют с глубокими изменениями функций хроматина и получающимися в результате этого изменениями состояний экспрессии генов и (или) стабильности хромосом. Установление связи между изменениями, наблюдаемыми на микроскопическом уровне, с молекулярными метками, обсуждаемыми повсюду в этой книге, остается одной из главных проблем в онкологических исследованиях. В этой главе мы рассматриваем эпигенетические метки, типичным примером которых являются изменения в метилировании цитозина ДНК, метилирование в динуклеотидах CpG и модификации гистонов, которые в раковых клетках распределены аномально. Их все чаще связывают с наследуемыми событиями, которые затрагивают стабильность и функционирование генома, и, таким образом, вносят весьма существенный вклад в злокачественный фенотип.
Известны несколько примеров роли хроматин модифицирующей активности при раковых заболеваниях у человека (Wolffe, 2001). Например, и острая миелоидная лейкемия (AML), и острая промиелоцитная лейкемия (PML) вызываются хромосомными транслокациями. которые изменяют использование диацетилаз гистонов (HDACs). При PML ген PML объединяется с рецептором ретиноидной кислоты (RAR). Этот рецептор рекрутирует активность HDAC и метилирование ДНК и вызывает состояние транскрипционного сайленсинга, что было показано с помощью экспериментальных промоторных конструктов. Эти данные предполагают, что такое «нацеливание» изменения хроматина может потенциально приводить к сайленсингу гена-супрессора опухоли, который участвует в блокировке клеточной дифференциации (Di Croce et al., 2002). При AML, ДНК-связывающий домен транскрипционного фактора AML-1 объединен с белком, который называется ЕТО и который взаимодействует с HDAC. Репрессия клеточной дифференцировки неправильно нацеленной HDAC способствует абберантной репрессии гена и, в конечном счете, лейкемии (Amann et al., 2001). Это всего два примера прямого включения модификаций хроматина в онкогенный фенотип. Однако становится ясно, что модификации хроматина могут прямо и косвенно изменять паттерны метилирования цитозина — эпигенетического изменения ДНК, которое может либо инициировать, либо «запереть» сайленсинг ключевых генов, что ведет к наследуемым нарушениям важнейших клеточных путей.
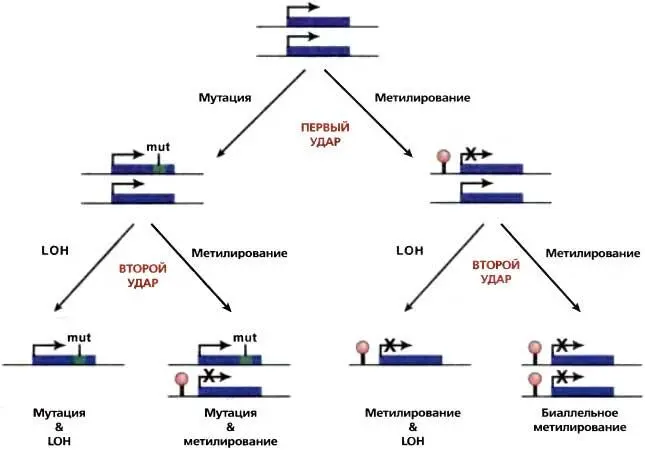
Рис. 24.2.Как метилирование ДНК может участвовать в инактивации генов-супрессоров опухоли
Две активные аллели гена-супрессора опухоли показаны как два синих прямоугольника в верхней части рисунка Первый шаг инактивации гена показан как локализованная мутация (слева) или генный сайленсинг за счет метилирования ДНК (справа). Следующий «удар» показан или как потеря гетерозиготности (LOH), или как транскрипционный сайленсинг в результате дополнительных эпигенетических событий. В этом случае метилирование ДНК может играть роль одного из путей, что согласуется с гипотезой Кнудсона
3. Роль метилирования ДНК при раковых заболеваниях
Первое открытие того, что ДНК кроме четырех оснований, содержит 5-метилцитозин, непосредственно включенный в ДНК, вскоре привело к предположению, что изменения в метилировании ДНК могут играть роль в онкогенезе (табл. 24.2). За последние 40 лет было проведено много исследований, которые показывали различия в паттернах распределения 5-метилцитозина ДНК человека между раковыми и нормальными клетками. Среди них есть как минимум три основных способа, с помощью которых метилирование CpG может участвовать в онкогенном фенотипе. Они включают в себя гипометилирование ракового генома, локальное гиперметилирование промоторов генов-супрессоров опухоли и прямой мутагенез (рис. 24.1) (Jones and Laird, 1999; Jones and Baylin, 2002; Herman and Baylin, 2003). Хотя каждое из этих отклонений само по себе могло бы способствовать возникновению раковых заболеваний у человека, может быть, особенно важно то, что они все имеют место одновременно, показывая, таким образом, что нарушения гомеостаза эпигенетических механизмов — это главные причины, вызывающие рак у людей.
Наиболее известное и раньше других установленное изменение в паттернах метилирования ДНК у раковых клеток — это общее уменьшение данной модификации, приводящее к нестабильности генома (дополнительное обсуждение см. в главе 18). Хорошо известно, что это является ключевым признаком рака у человека (Fein-berg and Vogelstein, 1983; Feinberg et al., 1988; Jones and Laird, 1999; Jones and Baylin, 2002; Herman and Baylin, 2003). В более поздний период времени возрастающий объем данных показал, что аномальное метилирование островков CpG в 5’-районах генов, относящихся к раковым заболеваниям, является составной частью их транскрипционного сайленсинга, обеспечивая альтернативный механизм мутаций для инактивации генов с функциями подавления опухоли (Jones and Laird, 1999; Jones and Baylin, 2002; Herman and Baylin, 2003). Наконец, в дополнении к вышеописанной роли метилирования цитозина в дестабилизации генома и генном сайленсинге, 5-метилцитозин сам по себе является высоко нестабильным и, поэтому, мутабельным основанием. Это напрямую может вносить свой вклад в развитие раковых заболеваний, вызывая мутации типа транзиций, при которых meCpG превращается в TpG (Rideout et al., 1990). Тот факт, что эти модификации столь распространены при раковых заболеваниях, и, как сейчас известно, приводят напрямую к канцерогенезу, также создает новые возможности терапевтической реверсии, направленной на эпигенетические изменения (Egger et al., 2004).
Читать дальшеИнтервал:
Закладка: